Explicamos o que é a tabela periódica e qual é a sua história. Além disso, como está organizado e quais são os diferentes grupos que contém.
O que é a Tabela Periódica?
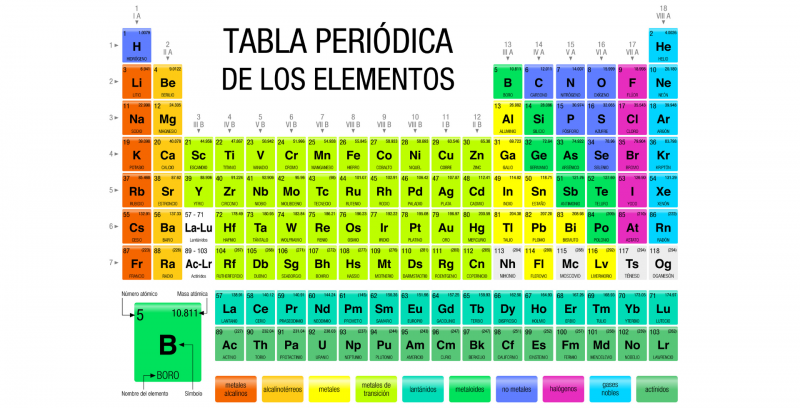
A tabela periódica dos elementos é um registro de todos os elementos químicos conhecidos pela humanidade. Os elementos são organizados em uma tabela de acordo com seu número atômico (número de prótons), sua configuração eletrônica e suas propriedades químicas.
Nesta tabela os itens estão dispostos em linhas e colunas que mostram uma certa periodicidade: os elementos que pertencem à mesma coluna têm propriedades semelhantes. Em princípio, toda a matéria conhecida no universo é composta de várias combinações dos 118 elementos, listados na Tabela Periódica.
símbolos foram estabelecidos, chamados de símbolos químicospara representar cada elemento da Tabela Periódica, que também são identificados de acordo com seus estados de agregação (sólido, líquido ou gasoso) à temperatura de 0 °C e pressão de 1 atm.
A tabela periódica é uma ferramenta fundamental para a química, biologia e outras ciências naturaisque é atualizado ao longo dos anos, à medida que aprendemos mais sobre as propriedades da matéria e as relações entre os elementos.
Veja também: ligação química
história da tabela periódica
A primeira versão da Tabela Periódica foi publicada em 1869. pelo professor de química russo Dmitri Mendeleev, e continha 63 dos 118 elementos conhecidos na natureza hoje e foi organizado com base em suas propriedades químicas. Por outro lado, o professor de química alemão Julius Lothar Meyer publicou uma versão ampliada, mas baseada nas propriedades físicas dos átomos. Ambos os estudiosos organizaram os elementos em fileiras, tendo a prudência de deixar espaços em branco onde pressentissem que haveria elementos ainda a serem descobertos.
Em 1871 Mendeleev publicou outra versão da Tabela Periódica. que agrupava os elementos de acordo com suas propriedades comuns em colunas numeradas de I a VIII de acordo com o estado de oxidação do elemento.
Finalmente, em 1923, o químico americano Horace Groves Deming publicou uma tabela periódica com 18 colunas identificadas, que é a versão utilizada atualmente.
Como está organizada a tabela periódica?
A tabela periódica atual é estruturada em sete linhas (horizontais) chamadas períodos e em 18 colunas (verticais) denominadas grupos o famílias. Os elementos químicos estão dispostos em ordem crescente de seus números atômicos, ou seja, o número atômico aumenta da esquerda para a direita no período e de cima para baixo no grupo.
Os dezoito grupos conhecidos são:
- Grupo 1 (IA). Metais alcalinos: lítio (Li), sódio (Na), potássio (K), rubídio (Rb), césio (Cs), frâncio (Fr). Também neste grupo está o hidrogênio (H), que é um gás.
- Grupo 2 (IIA). Metais alcalinos terrosos: berílio (Be), magnésio (Mg), cálcio (Ca), estrôncio (Sr), bário (Ba), rádio (Ra).
- Grupo 3 (IIIB). A família do escândio (Sc), que inclui o Ítrio (Y) e as terras raras: lantânio (La), cério (Ce), praseodímio (Pr), neodímio (Nd), promécio (Pm), samário (Sm), európio ( Eu), gadolínio (Gd), térbio (Tb), disprósio (Dy), hólmio (Ho), érbio (Er), túlio (Tm), itérbio (Yt), lutécio (Lu). Também estão incluídos os actinídeos: actínio (Ac), tório (Th), protactínio (Pa), urânio (U), neptúnio (Np), plutônio (Pu), amerício (Am), cúrio (Cm), berquélio (Bk) , califórnio (Cf), einstênio (Es), férmio (Fm), mendelévio (Md), nobel (No) e laurêncio (Lr).
- Grupo 4 (IVB). A família do titânio (Ti), que inclui o zircônio (Zr), o háfnio (Hf) e o ruterfórdio (Rf), este último sintético e radioativo.
- Grupo 5 (GB). A família do vanádio (V): nióbio (Nb), tântalo (Ta) e dúbnio (Db), este último é sintético.
- Grupo 6 (VIB). A família do cromo (Cr): molibdênio (Mb), tungstênio (W) e seabórgio (Sg), sendo este último sintético.
- Grupo 7 (VIIB). A família do manganês (Mn): rênio (Re), tecnécio (Tc) e bohrium (Bh), os dois últimos são sintéticos.
- Grupo 8 (VIIIB). A família do ferro (Fe): rutênio (Ru), ósmio (Os) e hássio (Hs), este último sintético.
- Grupo 9 (VIIIB). A família do cobalto (Co): ródio (Rh), irídio (Ir) e o meitneiro sintético (Mt).
- Grupo 10 (VIIIB). A família do níquel (Ni): paládio (Pd), platina (Pt) e o darmstadtium sintético (Ds).
- Grupo 11 (IB). A família do cobre (Cu): prata (Ag), ouro (Au) e o roentgênio sintético (Rg).
- Grupo 12 (IIB). A família do zinco (Zn): cádmio (Cd), mercúrio (Hg) e o copernício sintético (Cn).
- Grupo 13 (IIIA). As terras: boro (Br), alumínio (Al), gálio (Ga), índio (In), tálio (Tl) e o nihônio sintético (Nh).
- Grupo 14 (IVA). Os carbonóides: carbono (C), silício (Si), germânio (Ge), estanho (Sn), chumbo (Pb) e o flevorium sintético (Fl).
- Grupo 15 (VA). Os nitrogenóides: nitrogênio (N), fósforo (P), arsênico (As), antimônio (Sb), bismuto (Bi) e o moscóvio sintético (Mc).
- Grupo 16 (VIA). Calcogênios ou anfigênicos: oxigênio (O), enxofre (S), selênio (Se), telúrio (Te), polônio (Po) e o fígado sintético (Lv).
- Grupo 17 (VIIA). Os halogênios: flúor (F), cloro (Cl), bromo (Br), iodo (I), astato (At) e o tempo sintético (Ts).
- Grupo 18 (VIIIA). Os gases nobres: hélio (He), neônio (Ne), argônio (Ar), criptônio (Kr), xenônio (Xe), radônio (Rn) e o oganeson sintético (Og).
Referências
- “O ABC da Tabela Periódica” em Química e Sociedade. (PDF)
- “Química Inorgânica” de María Dolores de la Llata Loyola. Progresso Editorial (2001) ISBN: 9789706413536.
- “Química Inorgânica” por Therald Moeller. Nova versão atualizada, Editorial Reverté, SA ISBN: 8429173919.
