Explicamos o que é a regra do octeto na química, quem foi seu criador, exemplos e exceções. Além disso, a estrutura de Lewis.
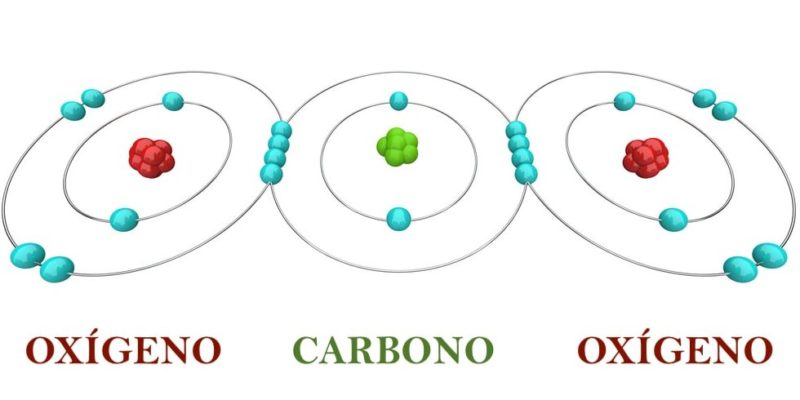
O que é a regra do octeto?
Em química, é conhecida como regra do octeto ou teoria do octeto. a explicação sobre a forma como os átomos dos elementos químicos são combinados.
Esta teoria foi enunciada em 1917 pelo físico-químico americano Gilbert N. Lewis (1875-1946) e explica que os átomos dos diferentes elementos tendem a manter sempre uma configuração eletrônica estável através da localização de oito elétrons em seus últimos níveis de energia.
A regra do octeto afirma que íons de diferentes elementos químicos encontrada na tabela periódica eles geralmente completam seus últimos níveis de energia com 8 elétrons. Devido a isso, as moléculas podem adquirir uma estabilidade semelhante à dos gases nobres (localizados na extrema direita da tabela periódica), cuja estrutura eletrônica (com seu último nível de energia cheio) os torna muito estáveis, ou seja, não muito reativo. .
Assim, elementos com alta eletronegatividade (como halogênios e anfigenes, ou seja, elementos do grupo 16 da Tabela) tendem a “ganhar” elétrons até atingir o octeto, enquanto aqueles com baixa eletronegatividade (como elementos alcalinos ou alcalino-terrosos) tendem para “perder” elétrons para alcançar o octeto.
Esta regra explica uma das maneiras pelas quais os átomos formam suas ligações, e a natureza destes dependerá do comportamento e das propriedades químicas das moléculas resultantes. Desta forma, a regra do octeto é um princípio prático que serve para prever o comportamento de muitas substâncias, embora também apresente diferentes exceções.
Veja também: ligação covalente
Exemplos da regra do octeto
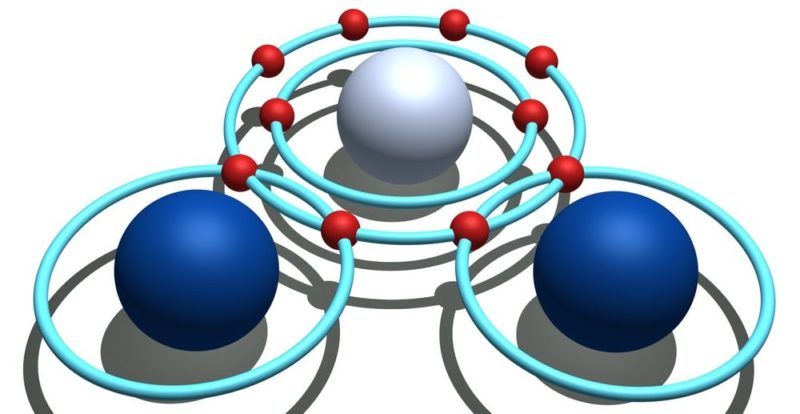
vamos pensar sobre uma molécula de CO2 cujos átomos possuem valências 4 (carbono) e 2 (oxigênio), unidos por ligações químicas duplas. (É importante esclarecer que a valência são os elétrons que um elemento químico deve abrir mão ou aceitar para atingir seu último nível de energia para ser completo. A valência química não deve ser confundida com os elétrons de valência, pois os últimos são os elétrons que estão localizados no último nível de energia.
esta molécula É estável se cada átomo tiver 8 elétrons no total em seu último nível de energia.atingindo o octeto estável, que é preenchido pelo compartilhamento de 2 elétrons entre os átomos de carbono e oxigênio:
- O carbono compartilha dois elétrons com cada oxigênio, aumentando de 6 para 8 os elétrons no último nível de energia de cada oxigênio.
- Ao mesmo tempo, cada oxigênio compartilha dois elétrons com o carbono, aumentando de 4 para 8 elétrons no último nível de energia do carbono.
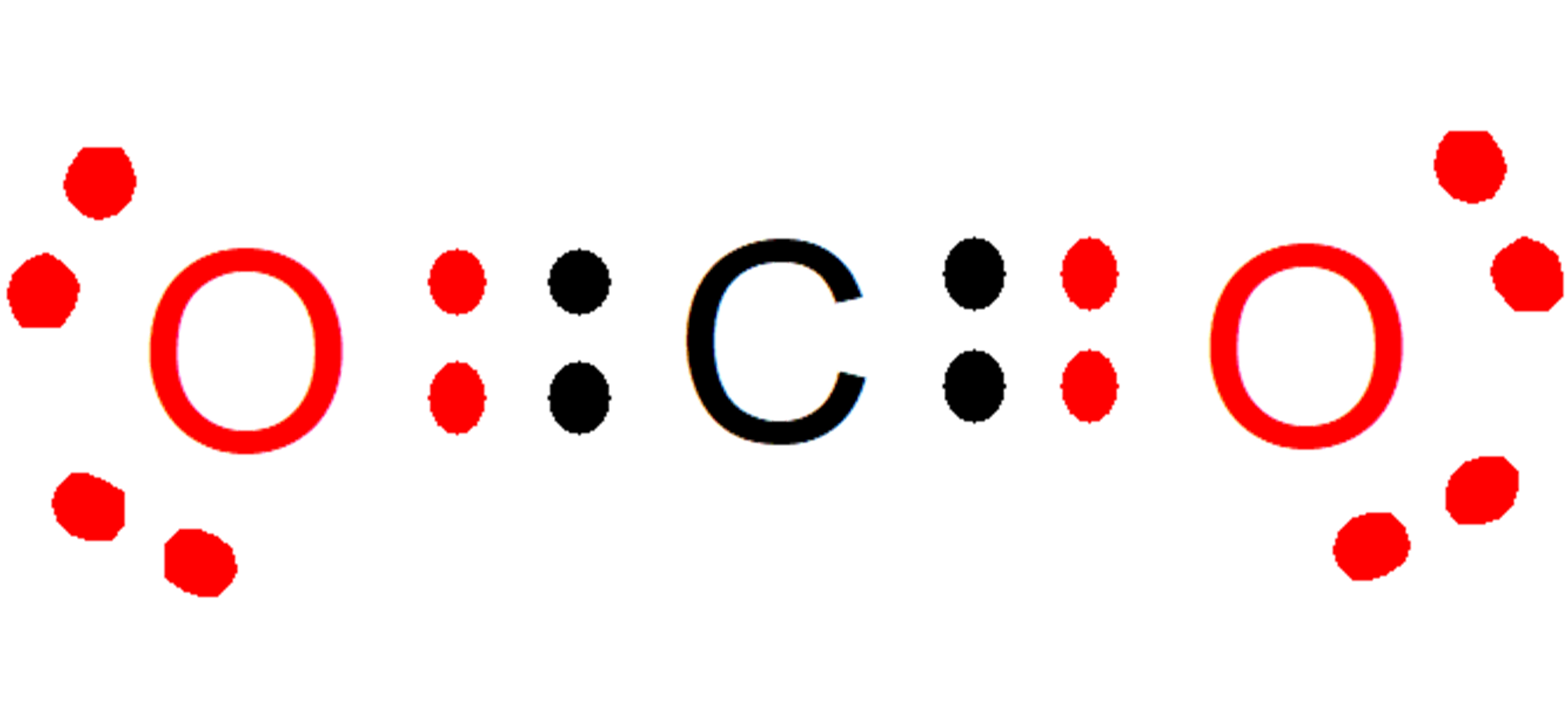
Outra maneira de ver isso seria que o total de elétrons dados e levados deve ser sempre oito.
É o caso de outras moléculas estáveis, como o cloreto de sódio (NaCl). O sódio contribui com seu único elétron (valência 1) para o cloro (valência 7) para completar o octeto. Assim, teríamos Na1+Cl1- (Isto é, o sódio cedeu um elétron e ganhou uma carga positiva, e o cloro aceitou um elétron e com ele uma carga negativa).
Exceções à regra do octeto
A regra do octeto tem várias exceções, ou seja, compostos que atingem sua estabilidade sem serem regidos pelo octeto de elétrons. átomos como o fósforo (P), enxofre (S), selênio (Se), silício (Si) ou hélio (He) eles podem acomodar mais elétrons do que o sugerido por Lewis (hipervalência).
Pelo contrário, o hidrogênio (H), que tem um único elétron em um único orbital atômico (a região do espaço onde é mais provável que um elétron seja encontrado ao redor do núcleo atômico), pode aceitar no máximo dois elétrons em uma ligação química. Outras exceções são os berílio (Be)que adquire estabilidade com apenas quatro elétrons, ou o boro (B)que o faz com seis.
Regra do octeto e estrutura de Lewis

Outra das grandes contribuições de Lewis para a química foi sua famosa maneira de representar as uniões atômicashoje conhecida como “estrutura de Lewis” ou “fórmula de Lewis”.
Consiste em colocar pontos ou traços para representar elétrons compartilhados em uma molécula e os elétrons que permanecem livres em cada átomo.
Este tipo de representação gráfica bidimensional permite saber a valência de um átomo que interage com outros em um composto e se forma ligações simples, duplas ou triplas, tudo isso afetará a geometria molecular.
Para representar uma molécula desta forma precisamos escolher um átomo central, que serão circundados pelos demais (chamados terminais) estabelecendo ligações até atingir as valências de todos os envolvidos. Os primeiros são geralmente os menos eletronegativos e os segundos os mais eletronegativos.
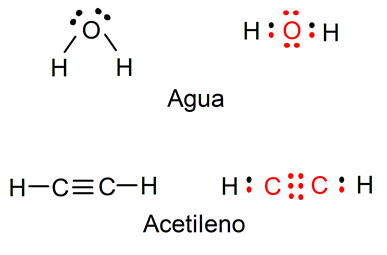
Por exemplo, a representação da água (H2O) mostra os elétrons livres que o átomo de oxigênio possuiAlém disso, as ligações simples entre o átomo de oxigênio e os átomos de hidrogênio podem ser visualizadas (os elétrons pertencentes ao átomo de oxigênio são representados em vermelho e os dos átomos de hidrogênio em preto). Também está representada a molécula de acetileno (C2H2), onde você pode visualizar a ligação tripla entre os dois átomos de carbono e as ligações simples entre cada átomo de carbono e um átomo de hidrogênio (os elétrons que pertencem aos átomos de carbono são representados em vermelho e os do hidrogênio em preto).
Continuar com: Oxidação
Referências
- “Regra do octeto” na Wikipedia.
- “Regra do Octeto” (vídeo) em Oakademia – Estude online e quando quiser.
- “Regra do Octeto” no Guia de Química.
- “O que é a regra do octeto?” no Laboratório Químico TP.
