Explicamos o que são os modelos atômicos e como eles evoluíram, desde a Antiguidade até os dias atuais.

O que são modelos atômicos?
Os modelos atômicos são conhecidos como os diferentes representações gráficas da estrutura e função dos átomos. Os modelos atômicos foram desenvolvidos ao longo da história da humanidade a partir das ideias que foram utilizadas em cada época a respeito da composição da matéria.
Os primeiros modelos atômicos datam da antiguidade clássica.quando os filósofos e naturalistas se aventuraram a pensar e deduzir a composição das coisas que existem, ou seja, da matéria.
Veja também: Regra do Octeto
Modelo atômico de Demócrito (450 aC)
A “Teoria Atômica do Universo” foi criada pelo filósofo grego Demócrito junto com seu mentor, Leucipo. Naquela época, o conhecimento não era obtido pela experimentação, mas pelo raciocínio lógico, baseado na formulação e discussão de ideias.
Demócrito Ele propôs que o mundo era feito de partículas muito pequenas e indivisíveis., de existência eterna, homogênea e incompressível, cujas únicas diferenças eram na forma e no tamanho, nunca no funcionamento interno. Essas partículas foram batizadas de “átomos”, palavra que vem do grego atemnein e significa “indivisível”.
Segundo Demócrito, as propriedades da matéria eram determinadas pela maneira como os átomos se agrupavam. Filósofos posteriores, como Epicuro, acrescentaram o movimento aleatório dos átomos à teoria.
Modelo Atômico de Dalton (1803 DC)
Dentro da química nasceu o primeiro modelo atômico com bases científicas, proposto por John Dalton em seus “Postulados Atômicos”. Ele sustentava que tudo era feito de átomos, indivisíveis e indestrutíveis.mesmo através de reações químicas.
Dalton propôs que os átomos do mesmo elemento químico eram iguais entre si e tinham a mesma massa e as mesmas propriedades. Por outro lado, ele propôs o conceito de peso atômico relativo (o peso de cada elemento em relação ao peso do hidrogênio), comparando as massas de cada elemento com a massa do hidrogênio. Ele também propôs que os átomos podem se combinar uns com os outros para formar compostos químicos.
A teoria de Dalton tinha algumas falhas. Ele afirmou que os compostos químicos foram formados usando o menor número possível de átomos de seus elementos. Por exemplo, a molécula de água, segundo Dalton, seria HO e não H2Ou, qual é a fórmula correta. Por outro lado, ele disse que os elementos no estado gasoso eram sempre monoatômicos (compostos por um único átomo), o que sabemos não ser real.
Mais em: Modelo atômico de Dalton
Modelo atômico de Lewis (1902 dC)
Também chamado de “Cubic Atom Model”, neste modelo Lewis propôs a estrutura dos átomos distribuídos na forma de um cubo, em cujos oito vértices estavam os elétrons. Isso permitiu avanços no estudo das valências atômicas e das ligações químicas, principalmente após sua atualização por Irving Langmuir em 1919, onde propôs o “átomo octeto cúbico”.
Esses estudos foram a base do que hoje é conhecido como diagrama de Lewis, uma ferramenta muito útil para explicar a ligação covalente.
Modelo Atômico de Thomson (1904 DC)

Proposto por JJ Thomson, descobridor do elétron em 1897, este modelo é anterior à descoberta de prótons e nêutrons, então assumiu que os átomos eram compostos de uma esfera de carga positiva e elétrons carregados negativamente estavam embutidos nele, como passas em pudim. Essa metáfora deu ao modelo o epíteto de “Modelo do Pudim de Passas”.
Este modelo fazia uma previsão incorreta da carga positiva no átomo, pois afirmava que esta estava distribuída por todo o átomo. Mais tarde isso foi corrigido no modelo de Rutherford onde o núcleo atômico foi definido.
Modelo atômico de Rutherford (1911 dC)
Ernest Rutherford realizou uma série de experimentos em 1911 usando folha de ouro. Nessas experiências ele determinou que o átomo é composto de um núcleo atômico carregado positivamente (onde está concentrada a maior parte de sua massa) e os elétrons, que giram livremente em torno desse núcleo. Neste modelo, a existência do núcleo atômico é proposta pela primeira vez.
Continue em: Modelo Atômico de Rutherford
Modelo atômico de Bohr (1913 AD)

Este modelo dá origem a postulados quânticos no mundo da física, então é considerada uma transição entre a mecânica clássica e a mecânica quântica. O físico dinamarquês Niels Bohr propôs este modelo para explicar como os elétrons poderiam ter órbitas estáveis (ou níveis de energia estáveis) ao redor do núcleo. Também explica por que os átomos têm espectros de emissão característicos.
Nos espectros feitos para muitos átomos, observou-se que os elétrons do mesmo nível de energia tinham energias diferentes. Isso mostrou que houve erros no modelo e que deve haver subníveis de energia em cada nível de energia.
O modelo de Bohr é resumido em três postulados:
- Os elétrons traçam órbitas circulares ao redor do núcleo sem irradiar energia.
- As órbitas permitidas aos elétrons são aquelas com um determinado valor de momento angular (L) (quantidade de rotação de um objeto) que é um múltiplo inteiro do valor , onde h=6,6260664×10-34 n = 1, 2, 3….
- Os elétrons emitem ou absorvem energia quando saltam de uma órbita para outra e, ao fazê-lo, emitem um fóton que representa a diferença de energia entre as duas órbitas.
Modelo atômico de Sommerfeld (1916 AD)
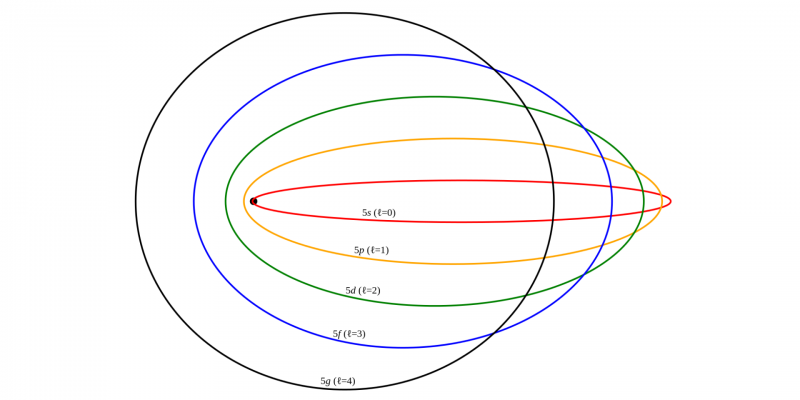
Este modelo foi proposto por Arnold Sommerfield para tentar cobrir as deficiências que o modelo de Bohr apresentava.
Baseava-se em parte nos postulados relativistas de Albert Einstein. Entre suas modificações está a afirmação de que as órbitas dos elétrons eram circulares ou elípticasque os elétrons tinham minúsculas correntes elétricas e que a partir do segundo nível de energia havia dois ou mais subníveis.
Modelo atômico de Schrödinger (1926 DC)
Proposto por Erwin Schrödinger a partir dos estudos de Bohr e Sommerfeld, Ele concebeu os elétrons como ondulações da matériaque permitiu a formulação posterior de uma interpretação probabilística da função de onda (magnitude usada para descrever a probabilidade de encontrar uma partícula no espaço) por Max Born.
Isso significa que a posição de um elétron ou seu momento podem ser estudados probabilisticamente, mas não ambos ao mesmo tempo, devido ao Princípio da Incerteza de Heisenberg.
Este é o modelo atômico atual no início do século 21, com algumas adições posteriores. É conhecido como o “Modelo de Ondas Quânticas”.
Referências
- “Fundamentos de Física” por Halliday, David. 8ª edição, Wiley (2007). ISBN 0-471-15950-6.
