Explicamos o que é uma ligação química e como são classificadas. Exemplos de ligações covalentes, ligações iônicas e ligações metálicas.
O que é uma ligação química?
Uma ligação química é a força que une os átomos para formar compostos químicos. Essa união confere estabilidade ao composto resultante. A energia necessária para quebrar uma ligação química é chamada de energia de ligação.
Nesse processo átomos desistem ou compartilham elétrons da camada de valência (a camada externa de um átomo onde se determina sua reatividade ou sua tendência a formar ligações), e se unem constituindo novas substâncias homogêneas (não misturas), inseparáveis por mecanismos físicos como filtragem ou peneiramento.
É fato que os átomos que compõem a matéria tendem a se unir por diversos métodos que equilibram ou compartilham suas cargas elétricas naturais para alcançar condições mais estáveis do que quando estão separados. ligações químicas constituem a formação de moléculas orgânicas e inorgânicas e, portanto, fazem parte da base da existência dos organismos vivos. Da mesma forma, as ligações químicas podem ser quebradas sob certas e certas condições..
Isso pode ocorrer submetendo compostos químicos a altas temperaturas, aplicando eletricidade ou causando reações químicas com outros compostos. Por exemplo, se aplicarmos eletricidade à água é possível separar as ligações químicas entre o hidrogênio e o oxigênio que o compõem, esse processo é chamado de eletrólise. Outro exemplo é adicionar grandes quantidades de energia térmica a uma proteína, o que levaria à sua desnaturação (perda da estrutura secundária de uma proteína) ou à quebra de suas ligações.
Veja também: modelos atômicos
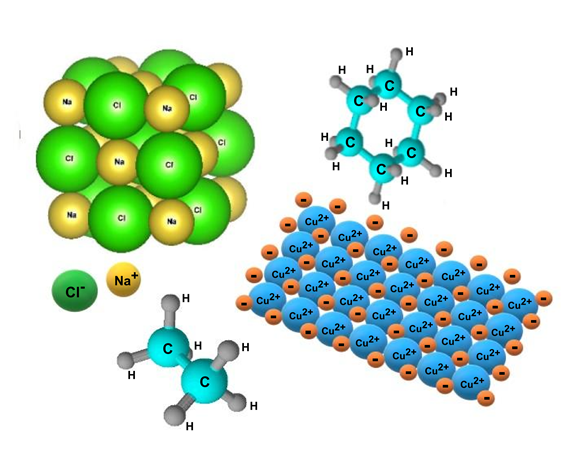
Tipos de ligação química
Existem três tipos conhecidos de ligações químicas, dependendo da natureza dos átomos envolvidos:
- Ligação covalente. Ocorre entre átomos não metálicos e cargas eletromagnéticas semelhantes (geralmente altas), que se unem e compartilham alguns pares de elétrons em sua camada de valência. É o tipo de ligação predominante nas moléculas orgânicas e pode ser de três tipos: simples (AA), dupla (A=A) e tripla (A≡A), dependendo do número de elétrons compartilhados.
- ligação iônica. Consiste na atração eletrostática entre partículas com cargas elétricas de sinais opostos chamadas de íons (partícula eletricamente carregada, que pode ser um átomo ou molécula que perdeu ou ganhou elétrons, ou seja, não é neutra).
- Ligação metálica. Ocorre apenas entre átomos metálicos do mesmo elemento, que geralmente formam estruturas sólidas e altamente compactas. É uma ligação forte, que une os núcleos atômicos entre si, rodeados por seus elétrons como em uma nuvem.
Exemplos de ligações químicas
Alguns exemplos de compostos ligados covalentemente:
- Bencino (C6H6)
- Metano (CH4)
- Glicose (C6H12O6)
- Amônia (NH3)
- Fréon (CFC)
- Em todas as formas de carbono (C): carvão, diamantes, grafeno, etc.
Alguns exemplos de compostos com ligação iônica:
- Óxido de magnésio (MgO)
- sulfato de cobre (CuSO4)
- Iodeto de potássio (KI)
- Cloreto de Manganês (MnCl2)
- carbonato de cálcio (CaCO3)
- sulfeto de ferro (Fe2S3)
Alguns exemplos de compostos de ligação metálica:
- Barras de ferro (Fe)
- depósitos de cobre (Cu)
- Barras de ouro puro (Au)
- Barras de prata pura (Ag)
