Explicamos o que é destilação, exemplos desse método de separação e os tipos de destilação que podem ser usados.

O que é destilação?
A destilação é chamada um método de separação de fases, que está entre os métodos de separação de misturas. A destilação consiste na utilização consecutiva e controlada de dois processos físicos: a vaporização e a condensação, utilizando-os seletivamente para separar os componentes de uma mistura geralmente de tipo homogêneo, ou seja, na qual não podem ser distinguidos a olho nu. componentes.
As misturas que podem ser separadas em seus componentes individuais usando destilação podem conter dois líquidos, um sólido em um líquido ou mesmo gases liquefeitos. Este método de separação baseia-se na diferença de pontos de ebulição (propriedade inerente da matéria, que é a temperatura na qual a pressão de vapor de um líquido se iguala à pressão ao redor do líquido) de diferentes substâncias. A substância com o ponto de ebulição mais baixo passará primeiro para a fase de vapor, depois essa substância se condensará em outro recipiente e permanecerá relativamente pura.
Desta forma, para que a destilação seja realizada corretamente, devemos ferver a mistura até atingir o ponto de ebulição de uma das substâncias constituintes, que se transformará em vapor e poderá ser conduzida para um recipiente resfriado, no qual é condensada. e torna-se um líquido novamente.
A outra substância componente, por outro lado, permanecerá no recipiente sem alterações; mas em ambos os casos teremos substâncias puras, livres da mistura inicial.
Pode servir para você: Filtração
Lei de Raoult
Quando temos uma mistura ideal de líquidos (uma mistura na qual as interações entre diferentes partículas são consideradas iguais às interações entre partículas iguais) a Lei de Raoult é cumprida.
Esta lei afirma que a pressão parcial de vapor de cada componente na mistura gasosa é igual à pressão de vapor do componente puro multiplicada por sua fração molar na mistura líquida.
A pressão de vapor total é então a soma das pressões parciais dos componentes da mistura na fase gasosa. Por outro lado, a fração molar de um componente em uma mistura é uma medida adimensional de sua concentração. As magnitudes mencionadas acima podem ser calculadas usando as seguintes equações:
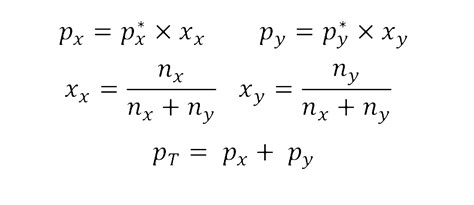
Onde:
- px y py são as pressões parciais dos componentes x e y respectivamente na mistura de vapor que envolve a mistura líquida.
- px* E Py* são as pressões de vapor dos componentes x e y.
- xx y xy são as frações molares dos componentes x e y na mistura líquida.
- nx y ny são a quantidade de substância dos componentes x e y na mistura líquida.
A Lei de Raoult declarada acima é válida para misturas ideais (que são um modelo estabelecido pelo ser humano para simplificar os estudos), mas na realidade esta lei sofre desvios quando a mistura é real.
Assim, se as diferentes partículas na mistura tiverem forças intermoleculares mais fortes do que as partículas no líquido puro, então a pressão de vapor da mistura é menor que a pressão de vapor do líquido puro, produzindo um desvio negativo da Lei de Raoult.
Se, por outro lado, as forças intermoleculares entre as partículas no líquido puro são maiores do que aquelas entre as partículas na misturaas partículas da mistura conseguirão escapar para a fase de vapor mais facilmente, então a pressão de vapor da mistura será maior, produzindo um desvio positivo da lei de Raoult
Quando se deseja destilar uma mistura azeotrópica (por exemplo, etanol e água), é necessário adicionar algum componente (benzeno, neste caso) para modificar o azeótropo e assim poder separar os componentes da mistura. Um azeótropo é uma mistura líquida com uma composição definida. que quando ferve, os vapores gerados têm a mesma composição da mistura (portanto, os componentes da mistura azeotrópica não podem ser separados por destilação simples ou fracionada).
Os azeótropos têm um ponto de ebulição definido, por exemplo, à pressão de 1 atm, o etanol ferve a 78,37°C e a água ferve a 100°C, enquanto o azeótropo etanol-água ferve a 78,2°C. c. As misturas azeotrópicas têm desvios negativos ou positivos da Lei de Raoult, conforme o caso.
tipos de destilação
A destilação pode ocorrer de diferentes maneiras:
- Destilação simples. A mais básica consiste em ferver a mistura até que os diferentes componentes se separem. É um método de separação eficaz quando os pontos de ebulição dos componentes da mistura diferem muito (o ideal é que tenham uma diferença de pelo menos 25°C, caso contrário, não garante a pureza total da substância destilada).
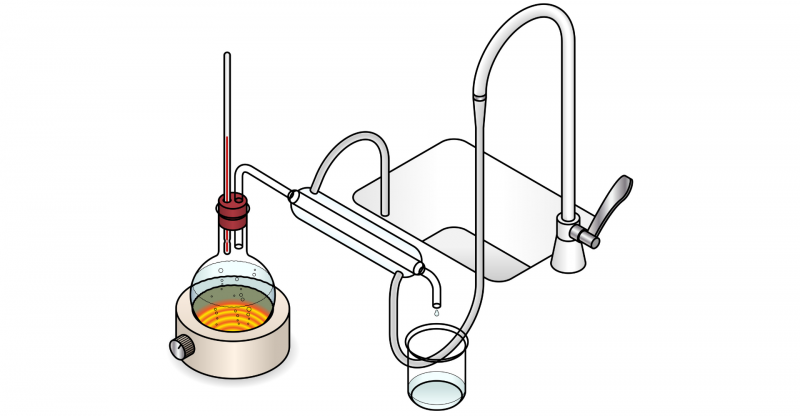
- Destilação fraccionada. É realizado através de uma coluna de fracionamento, que é composta por diferentes placas nas quais ocorre a vaporização e a condensação sucessivamente, garantindo maior pureza nos componentes separados.

- Destilação a vácuo. Ao baixar a pressão para gerar vácuo, o processo é catalisado para reduzir o ponto de ebulição dos componentes, pois alguns possuem pontos de ebulição muito altos que podem ser reduzidos quando a pressão é muito reduzida e, dessa forma, aceleram o processo de destilação. .
- Destilação azeotrópica. É a destilação necessária para quebrar um azeótropo, ou seja, uma mistura cujas substâncias se comportam como uma só, mesmo compartilhando o ponto de ebulição, de modo que não podem ser separadas por destilação simples ou fracionada. Para separar uma mistura azeotrópica é necessário modificar as condições de mistura, por exemplo, adicionando algum componente de separação.
- Destilação a vapor. Os componentes voláteis e não voláteis de uma mistura são separados por injeção direta de vapor.
- Destilação seca. Consiste em aquecer materiais sólidos sem a presença de solventes líquidos, obter gases e depois condensá-los em outro recipiente.
- Destilação Aprimorada. Também chamada de destilação alternada ou reativa, é adaptada aos casos específicos de misturas difíceis de separar ou que tenham o mesmo ponto de ebulição.
Exemplos de Destilação

- Refinaria de oléo. A separação dos diversos hidrocarbonetos presentes no petróleo é realizada por destilação fracionada, armazenando cada composto derivado do petróleo bruto de cozimento em diferentes camadas ou compartimentos separados de uma coluna de destilação. Esses gases sobem e se condensam nas camadas superiores da coluna, enquanto as substâncias mais densas, como asfalto e parafina, permanecem nas camadas inferiores.
- Cracking catalítico. Este é o nome dado a certas destilações a vácuo comuns no processamento de petróleo, utilizando torres de vácuo para separar os gases do cozimento do petróleo bruto. Isso acelera a ebulição dos hidrocarbonetos e acelera o processo. Cracking é um tipo de destilação destrutiva, na qual os hidrocarbonetos maiores são quebrados (em altas temperaturas e usando catalisadores) em hidrocarbonetos menores, que têm um ponto de ebulição mais baixo.
- Purificação de etanol. Para separar álcoois como o etanol da água durante sua produção em laboratório, utiliza-se uma destilação azeotrópica, adicionando-se à mistura benzeno ou outros componentes que promovam ou acelerem a separação, e que posteriormente possam ser facilmente removidos sem alterar a composição química do produto. .
- Processamento de carvão. Para a obtenção dos combustíveis orgânicos líquidos, utiliza-se o carvão ou a madeira através de processos de destilação a seco, de modo que os gases emitidos na combustão possam ser condensados.
- Termólise de sais minerais. Através da destilação a seco obtêm-se diversas substâncias minerais de grande utilidade industrial a partir da emanação e condensação de gases obtidos pela queima de sais minerais.
- O alambique. Esse é o nome dado ao aparelho inventado na antiguidade árabe, cuja finalidade é produzir perfumes, remédios e álcool a partir da fermentação de frutas. No seu funcionamento são utilizados os princípios da destilação: as substâncias são aquecidas numa pequena caldeira e os gases produzidos são arrefecidos numa serpentina que conduz a outro recipiente onde é recolhido o líquido produzido pela condensação dos referidos gases.
- Produção de perfumes. A destilação a vapor é utilizada para a obtenção de perfumes, fervendo a água junto com as flores em conserva para produzir um gás com o odor desejado e que, ao ser condensado, pode então ser utilizado como líquido base em perfumes.
