Explicamos o que é um composto químico, que tipos existem e a composição química da água. Além disso, os elementos químicos.

O que é um composto químico?
Um composto químico é qualquer substância formada pela união de dois ou mais tipos de elementos químicosisto é, por átomos de dois ou mais tipos diferentes de elementos químicos, ligados entre si por algum tipo de ligação química.
Um composto químico não pode ser separado em seus elementos constituintes por métodos físicos (destilação, decantação, etc). A única maneira de separar um composto químico em seus elementos constituintes é por meio de reações químicas.
O nível de complexidade de um composto químico pode ser muito simples ou muito complexo, isso depende do número de átomos que o formam e da forma como são combinados. Existem compostos formados por poucos átomos e compostos formados por centenas de átomos ligados entre si e ocupando posições muito específicas no composto.
Por exemplo, compostos químicos são substâncias binárias, como dióxido de carbono (CO2) ou água (H2QUALQUER). Assim como outros mais complexos, como o ácido sulfúrico (H2ENTÃO4) ou glicose (C6H12O6), ou mesmo macromoléculas inexprimíveis em uma fórmula química simples, como uma molécula de DNA humano.
Apesar de serem aglomerações mais ou menos complexas de elementos, os compostos químicos têm um conjunto estável de propriedades físicas e químicas.
Por outro lado, uma mudança aparentemente menor na configuração de seus átomos constituintes pode produzir mudanças radicais nessas propriedades, ou pode produzir substâncias inteiramente novas por meio de uma reação química.
Pode servir para você: Produto em química
Tipos de Compostos Químicos
Os compostos químicos podem ser classificados de acordo com dois critérios diferentes, que são:
- De acordo com o tipo de ligação entre seus átomos. Dependendo do tipo de ligação existente entre os elementos constituintes de um composto químico, eles podem ser classificados como:
- Moléculas. Unidos por ligações covalentes (compartilhamento de elétrons).
- íons. Unidos por ligações eletromagnéticas e dotados de carga positiva ou negativa.
- Compostos intermetálicos. Unidos por ligações metálicas, que obviamente tendem a ocorrer entre átomos do tipo metálico.
- complexos. Que mantêm suas longas estruturas unidas por meio de ligações covalentes coordenadas (é um tipo de ligação covalente em que o par de elétrons compartilhado é contribuído por apenas um dos átomos que participam dessa ligação).
- De acordo com a natureza de sua composição. Dependendo do tipo de átomos que os integram, eles podem ser classificados em:
- compostos orgânicos. São aqueles que têm como elemento base o carbono, em torno do qual se estruturam os demais átomos. Eles são os compostos fundamentais para a química da vida. Pode ser:
- Alifáticos. São compostos orgânicos que não são aromáticos. Eles podem ser lineares ou cíclicos.
- Aromáticos. São compostos orgânicos formados por estruturas com ligações conjugadas. Isso significa que uma ligação dupla ou tripla se alterna com uma ligação simples em toda a estrutura. Eles são muito estáveis.
- Heterocíclico. São compostos orgânicos cuja estrutura é cíclica, mas pelo menos um átomo do ciclo é um elemento diferente do carbono.
- Organometálicos. São compostos orgânicos nos quais um metal também faz parte de sua estrutura.
- Polímeros. São macromoléculas formadas por monômeros (moléculas menores).
- compostos inorgânicos. São aqueles cuja base nem sempre é o carbono. Eles são muito diversos na natureza e ocorrem em todos os estados de agregação. Estes são classificados em:
- Óxidos básicos. Eles são formados quando um metal reage com o oxigênio. Por exemplo: óxido de ferro (II) (FeO)
- Óxidos ácidos. Eles são formados por ligações entre o oxigênio e um elemento não metálico. Por exemplo: óxido de cloro(VII) (Cl2O7)
- Hidrocarbonetos. Podem ser metálicos e não metálicos. Hidretos metálicos são formados pela ligação de um ânion hidreto (H–) com carga elétrica negativa, com qualquer cátion metálico (carga positiva). Os hidretos não metálicos são formados pela união de um não metal (que neste caso sempre reage com seu estado de oxidação mais baixo) e hidrogênio. Os últimos são geralmente gasosos e são nomeados colocando-se o nome do não-metal seguido da frase -hidrogênio. Por exemplo: hidreto de lítio (LiH), hidreto de berílio (BeH2), fluoreto de hidrogênio (HF(g)), cloreto de hidrogênio (HCl(g)).
- hidrácidos. São compostos formados por hidrogênio e um ametal. Quando dissolvidos em água dão origem a soluções ácidas. Por exemplo: ácido fluorídrico (HF(ac)), ácido clorídrico (HCl(ac)).
- Hidróxidos (ou bases). São compostos formados pela união de um óxido básico e água. Eles são reconhecidos pelo grupo funcional hidroxila -OH. Por exemplo: hidróxido de chumbo(II) (Pb(OH)2), hidróxido de lítio (LiOH).
- Oxácidos. São compostos também chamados de oxoácidos ou oxiácidos (e popularmente “ácidos”). São ácidos que contêm oxigênio. Eles são formados quando um óxido de ácido e água reagem. Por exemplo: ácido sulfúrico (H2ENTÃO4), ácido hiposulfuroso (H2ENTÃO2).
- Vendas. Os sais são o produto da união de substâncias ácidas e básicas. São classificados como: neutros, ácidos, básicos e mistos.
- Sais neutros. Eles são formados pela reação entre um ácido e uma base ou hidróxido, liberando água no processo. Eles podem ser binários e ternários, dependendo se o ácido é um hidrácido ou oxácido, respectivamente. Por exemplo: cloreto de sódio (NaCl), tricloreto de ferro (FeCl3), fosfato de sódio (Na3DEPOIS DE4)
- Sais ácidos. Eles são formados pela substituição de hidrogênio em um ácido por átomos de metal. Por exemplo: hidrogenossulfato de sódio (VI) (NaHSO4).
- sais básicos Eles são formados pela substituição dos grupos hidroxila de uma base pelos ânions de um ácido. Por exemplo: dihidroxicloreto de ferro(III) (FeCl(OH)2).
- Sais mistos. Eles são produzidos substituindo os hidrogênios de um ácido por átomos metálicos de diferentes hidróxidos. Por exemplo: tetraoxossulfato de sódio e potássio (NaKSO4).
- compostos orgânicos. São aqueles que têm como elemento base o carbono, em torno do qual se estruturam os demais átomos. Eles são os compostos fundamentais para a química da vida. Pode ser:
Exemplos Diários de Compostos Químicos

É fácil encontrar exemplos cotidianos de compostos químicos. Dá só uma olhada na cozinha: os compostos químicos são os água (H2Ou o açúcar o sacarosa (C12H22O11), sal (NaCl), óleo (glicerol e três radicais carboxilatos) ou o vinagreque é uma diluição de ácido acético (C2H4O2).
O mesmo, embora em níveis muito mais elevados de complexidade, ocorre com o manteiga, queijo, leite ou vinho.
Elementos químicos e compostos químicos
elementos químicos são os diferentes tipos de átomos que compõem a matériae que se distinguem entre si pela configuração particular de suas partículas subatômicas (prótons, nêutrons e elétrons).
elementos químicos podem ser agrupados de acordo com suas propriedades químicas, isto é, às forças às quais eles respondem mais ou menos facilmente, ao comportamento que exibem em certas reações ou a outros traços estruturais próprios. Eles são representados, classificados e organizados na Tabela Periódica dos elementos.
Compostos químicos são combinações de elementos químicos de diferentes complexidades. Os elementos químicos são os menores pedaços de matéria que não podem ser decompostos. em pedaços menores por métodos físicos (é necessário recorrer a métodos químicos para isso).
Um exemplo de composto químico é a água. Este composto é formado por hidrogênio e oxigênio. Se a molécula de água puder ser decomposta, o oxigênio e o hidrogênio puro existirão em suas formas moleculares no estado gasoso O2 y H2.
composição química da água
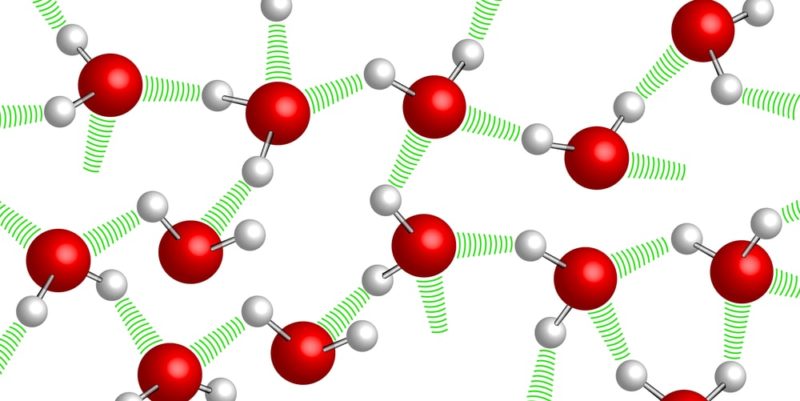
Conforme indicado por sua fórmula química (H2O), apesar de ser uma substância simples, A água é um composto químico formado por dois tipos de elementos: hidrogênio (H) e oxigênio (O).em proporção fixa e determinada em cada uma de suas moléculas: dois átomos de hidrogênio para cada átomo de oxigênio.
Esses átomos estão ligados por ligações covalentes, que conferem grande estabilidade à molécula. Além disso, conferem-lhe propriedades dipolares que permitem a formação de pontes entre os átomos de hidrogénio de uma molécula de água e os restantes (pontes de hidrogénio).
Continue com: Química Inorgânica
Referências
- “Composto químico” na Wikipedia.
- “O que são compostos químicos?” na Área de Ciências.
- “Composto Químico” no Science Daily.
- “Composto químico” na Enciclopédia Britânica.
