Explicamos o que são álcoois, sua classificação, nomenclatura e propriedades. Além disso, exemplos e importância na indústria.
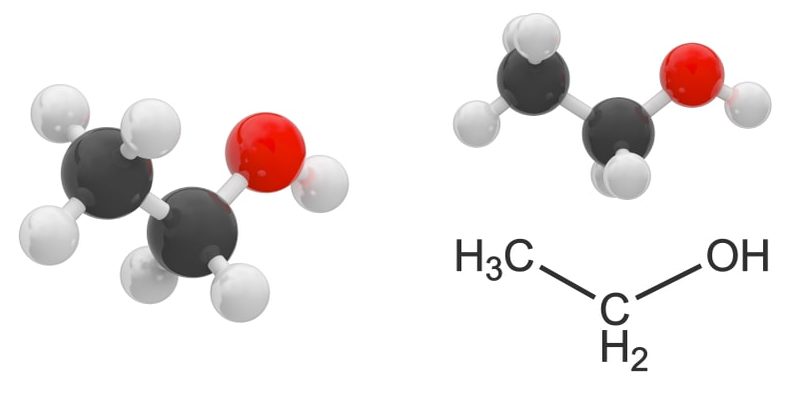
O que são álcoois?
álcoois são verdadeiros compostos químicos orgânicos, que apresentam em sua estrutura um ou mais grupos químicos hidroxila (-OH) ligado covalentemente a um átomo de carbono saturado (ou seja, ligado apenas a átomos adjacentes), formando um grupo carbinol (-C-OH).
Álcoois são compostos orgânicos muito comum na naturezaque desempenham papéis importantes nos organismos vivos, especialmente na síntese orgânica.
Seu nome vem do árabe al-kukhūl, que se traduz literalmente como “espírito” ou “líquido destilado”. Isso ocorre porque os antigos alquimistas muçulmanos chamavam os álcoois de “espírito” e, além disso, aperfeiçoaram os métodos de destilação no século IX. Estudos posteriores permitiram conhecer a natureza química desses compostos, destacando-se as contribuições de Lavoisier a respeito da fermentação da levedura de cerveja.
álcoois Eles podem ser tóxicos e até letais para o corpo humano se ingeridos em altas doses.. Além disso, quando consumidos por humanos, podem atuar como depressores do sistema nervoso central, causar intoxicação e provocar um comportamento mais desinibido do que o normal.
Por outro lado, os álcoois possuem propriedades antibacterianas e antissépticas que permitem seu uso na indústria química e na medicina.
Pode servir para você: Matéria orgânica
tipos de álcoois
Os álcoois podem ser classificados de acordo com o número de grupos hidroxila que apresentam em sua estrutura:
Monoálcoois ou álcoois. Estes contêm um único grupo hidroxila. Por exemplo:

Poliálcoois ou polióis. Eles contêm mais de um grupo hidroxila. Por exemplo:
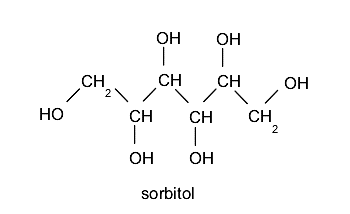
Outra forma de classificar os álcoois é de acordo com a posição do carbono ao qual o grupo hidroxila está ligado, levando em consideração também a quantos átomos de carbono esse carbono também está ligado:
- Álcoois primários. O grupo hidroxila (-OH) está localizado em um carbono ligado por sua vez a outro único átomo de carbono. Por exemplo:

- Álcoois secundários. O grupo hidroxila (-OH) está localizado em um carbono ligado por sua vez a dois outros átomos de carbono diferentes. Por exemplo:
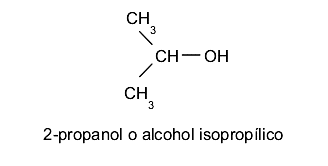
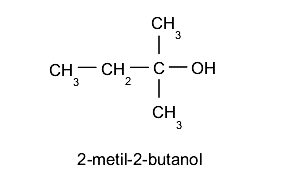
- Álcoois terciários. O grupo hidroxila (-OH) está localizado em um carbono ligado sucessivamente a três outros átomos de carbono diferentes. Por exemplo:
Nomenclatura do álcool
Como outros compostos orgânicos, os álcoois têm nomes diferentes, que explicaremos a seguir:
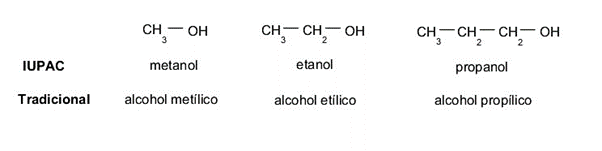
- Método tradicional (não sistêmico). Atente-se, antes de tudo, para a cadeia carbônica à qual a hidroxila (geralmente um alcano) está ligada, para resgatar o termo com que é nomeada, prefixe a palavra “álcool” e depois adicione o sufixo -il no lugar de -ano. Por exemplo:
- Se for uma cadeia de metano, será chamada álcool metílico.
- Se for uma cadeia de etano, será chamada álcool etilico.
- Se for uma cadeia de propano, será chamada álcool propílico.
- Método IUPAC. Como no método anterior, será dada atenção ao hidrocarboneto precursor, para resgatar seu nome e simplesmente adicionar a desinência -ol ao invés de -ano. Por exemplo:
- Se for uma cadeia de metano, será chamada metanol.
- Se for uma cadeia de etano, será chamada etanol.
- Se for uma cadeia de propano, será chamada propanol.
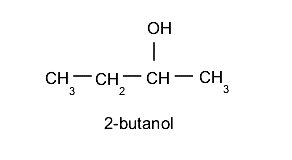
Eventualmente, será necessário indicar de alguma forma a localização do grupo hidroxila na cadeia, para o qual é utilizado um número no início do nome. É importante levar em consideração que a cadeia de hidrocarboneto mais longa é sempre escolhida como cadeia principal e a posição do grupo hidroxila deve ser selecionada usando a menor numeração possível. Por exemplo: 2-butanol.
Mais em: Nomenclatura química
Propriedades físicas dos álcoois
Os álcoois são geralmente líquidos incolores que apresentam odor característico, embora também possam, com menor abundância, existir no estado sólido. Eles são solúveis em água, pois o grupo hidroxila (-OH) tem alguma semelhança com a molécula de água (H2O), o que lhes permite formar pontes de hidrogênio. Nesse sentido, os álcoois mais solúveis em água são aqueles de menor massa molecular, ou seja, aqueles com estruturas menores e mais simples. À medida que o número de átomos de carbono e a complexidade da cadeia de carbono aumentam, os álcoois são menos solúveis em água.
o densidade de álcoois é maior de acordo com o aumento do número de átomos de carbono e as ramificações de sua cadeia de hidrocarbonetos. Por outro lado, a formação de ligações de hidrogênio não só influencia sua solubilidade, mas também seus pontos de fusão e ebulição. Quanto maior a cadeia de hidrocarbonetos, mais grupos hidroxila ela possui e, quanto mais ramificações ela possui, maiores são os valores dessas duas propriedades.
Propriedades químicas dos álcoois
álcoois tem caráter dipolar, semelhante ao da água, devido ao seu grupo hidroxila. Isso os torna substâncias polares (com um pólo positivo e um negativo).
Por causa disso, os álcoois pode se comportar como ácidos o como bases dependendo de qual reagente eles reagem. Por exemplo, se um álcool reage com uma base forte, o grupo hidroxila é desprotonado e o oxigênio retém sua carga negativa, agindo como um ácido.
Por outro lado, se um álcool é confrontado com um ácido muito forte, os pares de elétrons do oxigênio fazem com que o grupo hidroxila fique protonado, adquirindo uma carga positiva e se comportando como uma base fraca.
Por outro lado, os álcoois podem participar das seguintes reações químicas:
- Halogenação. Álcoois reagem com haletos de hidrogênio para dar haletos de alquila e água. Os álcoois terciários reagem mais facilmente do que os álcoois primários e secundários. Alguns exemplos dessas reações são:
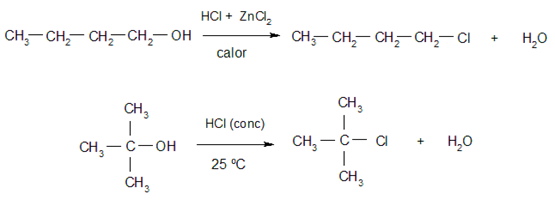
- Oxidação. Os álcoois são oxidados pela reação com certos compostos oxidantes, formando diferentes produtos dependendo do tipo de álcool que é oxidado (primário, secundário ou terciário). Por exemplo:
- Álcoois primários. Ocorrem se, ao serem oxidados, perdem um átomo de hidrogênio que está ligado ao carbono, que por sua vez está ligado ao grupo hidroxila, formam aldeídos. Por outro lado, se eles perdem os dois átomos de hidrogênio desse carbono, formam ácidos carboxílicos.
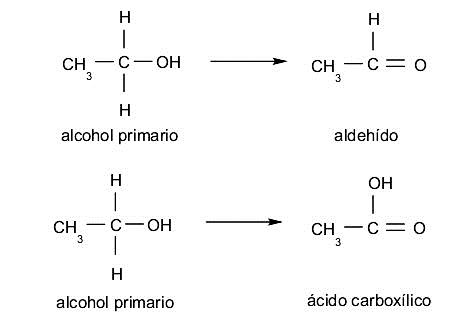
- Álcoois primários. Ocorrem se, ao serem oxidados, perdem um átomo de hidrogênio que está ligado ao carbono, que por sua vez está ligado ao grupo hidroxila, formam aldeídos. Por outro lado, se eles perdem os dois átomos de hidrogênio desse carbono, formam ácidos carboxílicos.
-
- Álcoois secundários. Após a oxidação, eles perdem o único átomo de hidrogênio ligado ao carbono que possui o grupo hidroxila e formam cetonas.

- Álcoois terciários. São resistentes à oxidação, ou seja, não enferrujam, a não ser que lhes sejam impostas condições muito específicas.
- Álcoois secundários. Após a oxidação, eles perdem o único átomo de hidrogênio ligado ao carbono que possui o grupo hidroxila e formam cetonas.
- Desidrogenação. Álcoois (somente primários e secundários) quando submetidos a altas temperaturas e na presença de certos catalisadores, perdem hidrogênio para formar aldeídos e cetonas.

- desidratação. Consiste na adição de um ácido mineral a um álcool para extrair o grupo hidroxila e obter o alceno correspondente por meio de processos de eliminação.

Importância dos álcoois

Os álcoois são substâncias de grande valor químico. Como matéria-prima, usado para obter outros compostos orgânicos, em laboratórios. Além disso como componente de produtos industriais para uso diário, como desinfetantes, limpadores, solventes, base de perfume.
Também são utilizados na fabricação de combustíveis, principalmente na indústria de biocombustíveis, uma alternativa aos de origem fóssil. É comum vê-los em hospitais, kits de primeiros socorros ou similares.
Por outro lado, certos álcoois são para consumo humano (especialmente o etanol), parte de muitas aguardentes em diferentes graus de refinamento e intensidade.
Exemplos de álcoois
Alguns exemplos de álcoois amplamente utilizados no dia a dia são:
- metanol o alcohol metílico (CH3OH)
- etanol o alcohol etílico (C2H5OH)
- 1-propanol, propanol ou álcool propílico (C3H7OH)
- isobutanol (C4H9OH)
Continuar com: Biomoléculas
Referências
- “Álcool” na Wikipedia.
- “Estudo de algumas propriedades dos álcoois” na Universidade Autônoma do Estado de Hidalgo.
- “Nomenclatura orgânica: álcoois” (vídeo) em Quimiayudas.
- “Alcohols” (vídeo) na Khan Academy.
- “Álcool” no Science Daily.
- “Álcool” no Lumen Learning.
- “Álcool (composto químico)” na Enciclopédia Britânica.
