Explicamos o que são ácidos e bases, suas características, indicadores e exemplos. Além disso, qual é a reação de neutralização.

O que são ácidos e bases?
E ácido é uma substância química capaz de doar prótons (H+) a outro produto químico. UMA base é aquela substância química capaz de capturar prótons (H+) de outro produto químico.
No entanto, existem duas teorias fundamentais para explicar o que são ácidos e bases: a teoria de Arrhenius e a teoria de Brönsted-Lowry.
Segundo a teoria de Arrhenius:
Um ácido é uma substância que doa prótons (H+) em solução aquosa. Ou seja, é uma substância neutra, que quando dissolvida em água se dissocia em seus íons de acordo com a seguinte reação representativa:
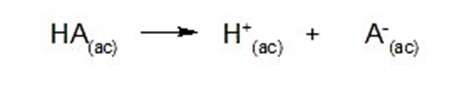
Por exemplo: ácido clorídrico (HCl)
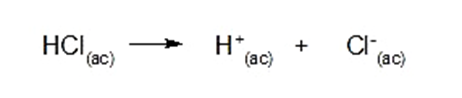
Uma base é uma substância que desiste de íons OH.– em solução aquosa. Por exemplo: hidróxido de sódio (NaOH)
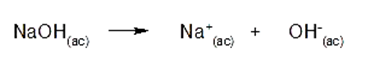
Essa teoria tem suas limitações, pois segundo ela esses compostos são definidos apenas em solução aquosa e não em outros meios. Além disso, não explica compostos como a amônia (NH3), que é uma base, mas não possui OH– em sua composição, não atende à definição de uma base de Arrhenius.
Por tudo isso, era necessária uma nova teoria que explicasse melhor os conceitos de ácido e base. Mais tarde, Brönsted e Lowry desenvolveram uma nova teoria, que inclui os princípios de Arrhenius, mas não é pensada apenas em solução aquosa e, portanto, é muito mais ampla.
De acordo com a teoria de Brönsted-Lowry:
De acordo com essa teoria, um ácido é uma substância química capaz de doar prótons (H+) a outra substância química e uma base é aquela substância química capaz de capturar prótons (H+) de outro produto químico.
De acordo com esta teoria, uma reação ácido-base é um equilíbrio que pode ser expresso como:
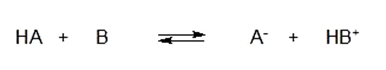
Onde HA se comporta como um ácido, pois doa um próton H+ ficar como A–. Por outro lado, B se comporta como uma base, pois captura um próton H+ para se tornar HB+.
Algumas substâncias podem se comportar como ácidos e bases ao mesmo tempo e são ditas anfotéricas. Isso depende do ambiente em que estão ou com quem reagem. Um exemplo desse tipo de substância é a água:
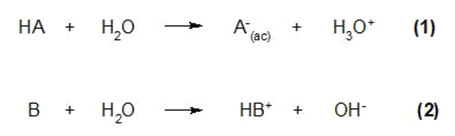
Na primeira equação, a água captura um próton H+comportando-se como uma base e tornando-se H3O+. Enquanto na equação (2), a água cede um próton H+comportando-se como um ácido e tornando-se OH–.
Como visto em ambas as teorias, ácidos e bases têm diferentes proporções de íons de hidrogênio (H+). Isso determina sua acidez (no caso de ácidos) ou sua alcalinidade ou basicidade (no caso de bases).
O pH é a grandeza que serve para medir a acidez ou alcalinidade de uma solução, ou seja, indica a concentração de íons de hidrogênio presentes nela.
- ácidos. Substâncias com pH de 0 a 6.
- Neutros. Substância com pH 7 (água).
- Bases/álcalis. Substâncias com pH de 8 a 14.
Quanto menor o pH de uma substância, maior o seu grau de acidez. Por exemplo, o HCl puro tem um pH próximo de 0. Por outro lado, quanto maior o pH de uma substância, maior seu grau de alcalinidade. Por exemplo, a soda cáustica tem um pH de 14.
Pode te ajudar: Química inorgânica
Características dos ácidos e bases
tanto ácidos como bases podem existir como líquidos, sólidos ou gases. Por outro lado, podem existir como substâncias puras ou diluídas, conservando muitas de suas propriedades.
A diferença de pH é a característica mais perceptível de cada. Quando o valor do pH de um composto atinge um de seus extremos, significa que esse composto é altamente perigoso para a maioria das matérias, tanto orgânicas quanto inorgânicas.
Ácidos e bases têm características físicas diferentes:
ácidos
- Possuem sabor azedo (por exemplo: ácido presente em diversas frutas cítricas).
- Eles são altamente corrosivos e podem causar queimaduras químicas na pele ou danos respiratórios se seus gases forem inalados.
- São bons condutores de eletricidade em soluções aquosas.
- Eles reagem com metais produzindo sais e hidrogênio.
- Eles reagem com óxidos metálicos para formar sal e água.
bases
- Eles têm um sabor amargo característico.
- São bons condutores de eletricidade em soluções aquosas.
- São irritantes para a pele: dissolvem a gordura da pele e podem destruir a matéria orgânica devido ao seu efeito cáustico. Sua respiração também é perigosa.
- Eles têm um toque de sabão.
- Eles são solúveis em água.
Ácidos e bases no dia a dia

A presença de ácidos e bases em nossa vida diária é abundante. Por exemplo, dentro das baterias de nossos aparelhos eletrônicos costuma haver ácido sulfúrico. Por isso, quando estragam e seu conteúdo é derramado dentro do aparelho, eles reagem com o metal dos eletrodos e criam um sal esbranquiçado.
Além disso existem ácidos suaves com os quais lidamos diariamentecomo ácido acético (vinagre), ácido acetilsalicílico (aspirina), ácido ascórbico (vitamina C), ácido carbônico (presente em refrigerantes), ácido cítrico (presente em frutas cítricas) ou ácido clorídrico (o suco gástrico que nosso secreção estomacal para dissolver a comida).
Sobre as bases, O bicarbonato de sódio é usado em panificação, como desodorante e em vários remédios para azia.. Outras bases comumente usadas são carbonato de sódio (detergente), hipoclorito de sódio (alvejante para limpeza), hidróxido de magnésio (laxante) e hidróxido de cálcio (cal de construção).
Indicadores de ácido e base
A maneira de distinguir entre um composto ácido e um básico é medindo seu valor de pH. Atualmente, existem vários métodos para medir o pH de uma substância.
- Usando indicadores ácido-base. Os indicadores são compostos que mudam de cor quando o pH da solução em que se encontram muda. Por exemplo, a fenolftaleína é um líquido que fica rosa quando adicionado a uma base e incolor quando adicionado a um ácido. Outro exemplo é o papel tornassol, que é imerso em uma solução e se ficar vermelho ou laranja será uma substância ácida e se ficar escuro será uma solução básica.
- Usando um potenciômetro ou medidor de pH. Existem equipamentos eletrônicos que nos fornecem diretamente o valor do pH de uma solução.
reação neutralizadora
A reação de neutralização ou (reação ácido-base) é uma reação química que ocorre quando esses dois tipos de compostos são misturados, obtendo em troca um sal e uma certa quantidade de água. Essas reações são geralmente exotérmicas (geram calor) e recebem esse nome pelo fato de que as propriedades do ácido e da base se anulam.
Para classificar as reações de neutralização, é importante conhecer os tipos de ácidos e bases.
- ácido forte. É um ácido que quando está em solução aquosa fica completamente ionizado, ou seja, se transforma completamente nos íons que compõem sua molécula. Por exemplo: HCl(ac)HBr(ac)H2ENTÃO4(ac).
- Fundação forte É uma base que quando está em solução aquosa fica completamente ionizada, ou seja, se transforma completamente nos íons que compõem sua molécula. Por exemplo: NaOH(ac)LiOH(ac)KOH(ac).
- ácido fraco. É um ácido que quando está em solução aquosa se ioniza parcialmente, ou seja, não se transforma completamente nos íons que compõem sua molécula. Portanto, a concentração de íons em solução desse tipo de ácido é menor do que em uma solução forte. Por exemplo: ácido cítrico, ácido carbônico (H2CO3)
- base fraca. É uma base que quando em solução aquosa se ioniza parcialmente. Ou seja, NÃO é totalmente transformado nos íons que compõem sua molécula. Portanto, a concentração de íons em solução desse tipo de base é menor do que em uma forte. Por exemplo: amônia (NH3), hidróxido de amônio (NH4OH)
As reações de neutralização podem ocorrer de quatro maneiras, dependendo das propriedades de seus reagentes:
- Um ácido forte e uma base forte. O reagente mais abundante permanecerá em solução em relação ao outro. O pH da solução resultante dependerá de qual reagente estiver em maior proporção.
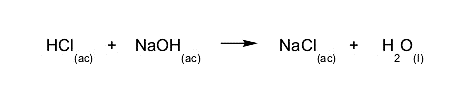
- Um ácido fraco e uma base forte. Uma solução básica de pH será obtida, a base permanecerá na solução.
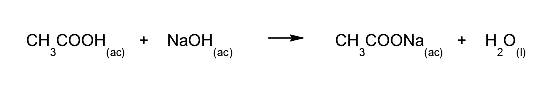
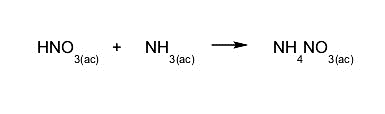
- Um ácido forte e uma base fraca. O ácido é neutralizado e uma proporção de ácido permanecerá em solução, dependendo do grau de concentração do ácido. O pH da solução resultante é ácido.
- Um ácido fraco e uma base fraca. O resultado será ácido ou básico dependendo das concentrações de seus reagentes.
Exemplos de Ácidos e Bases
ácidos
-
- Ácido clorídrico (HCl)
- ácido sulfúrico (H2ENTÃO4)
- ácido nítrico (HNO3)
- Ácido perclórico (HClO4)
- Ácido fórmico (CH2O2)
- Ácido brômico (HBrO3)
- ácido bórico (H3BO3)
- Ácido acético (C2H4O2)
bases
- Soda cáustica (NaOH)
- Hidróxido de calcio (Ca(OH)2)
- Amônia (NH3)
- Bicarbonato de sódio (NaHCO3)
- Hidróxido de Potássio (KOH)
- Hipoclorito de sódio (NaClO)
- Fluoreto de cálcio (CaF2)
- Hidróxido de bario (Ba[OH]2)
- Hidróxido de ferro (III) (Fe[OH]3)
Continuar com: Fórmula Química
Referências
- “Ácidos e bases” na KhanAcademy.
- “Ácidos e Bases em Biologia” em cK-12.
- “Neutralização de ácidos e bases” na Universidade do País Basco.
- “Ácidos e bases” em Encyclopedia.com.
- “Ácidos e Bases” no Lumen Learning.
- “Ácidos e Bases” na BBC Bitesize.
