Explicamos o que é uma bateria e como esse dispositivo funciona. Além disso, os tipos de baterias existentes e o que é uma bateria.

O que é uma bateria?
Uma bateria elétrica, também chamada de bateria ou acumulador elétrico, é um artefato formado por células eletroquímicas capazes de converter a energia química contida em seu interior em energia elétrica. Assim, as baterias geram corrente contínua e, desta forma, Eles são usados para alimentar vários circuitos elétricos.dependendo do seu tamanho e potência.
as baterias Eles foram totalmente incorporados em nossas vidas diárias desde sua invenção no século XIX. e sua comercialização massiva no século XX. O desenvolvimento das baterias anda de mãos dadas com o avanço tecnológico da eletrônica. Controles remotos, relógios, computadores de todos os tipos, telefones celulares e um enorme grupo de dispositivos contemporâneos usam baterias como fonte de energia, por isso são fabricados com várias potências.
as baterias têm uma capacidade de carga determinada pela natureza da sua composição e que é medido em amperes-hora (Ah), o que significa que a bateria pode fornecer um ampere de corrente durante uma hora contínua. Quanto maior sua capacidade de carga, mais corrente ele pode armazenar em seu interior.
Finalmente, o curto ciclo de vida da maioria das baterias comerciais as transformou em um poderoso poluente da água e do solo, pois uma vez que seu ciclo de vida termina, elas não podem ser recarregadas ou reutilizadas, e são descartadas. Após a oxidação de sua cobertura metálica, as baterias liberam seu conteúdo químico no meio ambiente e alteram sua composição e pH.
Veja também: Condutividade elétrica
Como funciona uma bateria?

O princípio fundamental de uma bateria consiste em reações de oxidação-redução (redox) de certos produtos químicosum dos quais perde elétrons (oxida) enquanto o outro ganha elétrons (reduz), podendo retornar à sua configuração inicial dadas as condições necessárias: a aplicação de eletricidade (carga) ou o fechamento do circuito (descarga).
as baterias contêm células químicas que têm um pólo positivo (ânodo) e um pólo negativo (cátodo), bem como eletrólitos que permitem o fluxo elétrico para o exterior. Essas células convertem energia química em eletricidade, por meio de um processo reversível ou irreversível, dependendo do tipo de bateria, que uma vez completada, esgota sua capacidade de receber energia. Existem dois tipos de células:
- primárias. Aqueles que, uma vez produzida a reação, não podem retornar ao seu estado original, esgotando sua capacidade de armazenar corrente elétrica. Eles também são chamados de baterias não recarregáveis.
- Escolas de ensino médio. Aqueles que podem receber uma aplicação de energia elétrica para restaurar sua composição química original, podendo ser usados inúmeras vezes antes de serem totalmente esgotados. Eles também são chamados de baterias recarregáveis.
tipos de bateria

Existem muitos tipos de baterias, dependendo dos elementos utilizados em sua fabricação, como:
- Pilhas alcalinas. Comumente descartável. Eles usam hidróxido de potássio (KOH) como eletrólito. A reação química que produz energia ocorre entre o zinco (Zn, ânodo) e o dióxido de manganês (MnO2, cátodo). São baterias extremamente estáveis, mas de curta duração.
- Baterias de chumbo-ácido. Comum em veículos e motocicletas. São baterias recarregáveis que quando carregadas possuem dois eletrodos de chumbo: um cátodo de dióxido de chumbo (PbO2) e um ânodo de chumbo (Pb) esponjoso. O eletrólito utilizado é o ácido sulfúrico (H2ENTÃO4) em solução aquosa. Por outro lado, quando a bateria está descarregada, o chumbo está na forma de sulfato de chumbo(II) (PbSO4) depositado sobre chumbo metálico (Pb). Assim, durante a carga inicial, o PbSO4 é reduzido a Pb em placas negativas, e PbO é formado2 nas positivas. Nesse processo, o chumbo é oxidado e reduzido ao mesmo tempo. Por outro lado, durante a descarga, o PbO2 se reduzir um PbSO4 e o Pb é oxidado para também produzir PbSO4. Esses dois processos podem ser repetidos ciclicamente até que os cristais de PbSO4 eles se tornam muito grandes e perdem a reatividade química. É o caso em que se diz coloquialmente que a bateria vazou e deve ser substituída por uma nova.
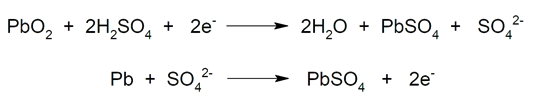
- baterias de níquel. Custo baixíssimo, mas desempenho péssimo, são alguns dos primeiros a serem fabricados na história. Por sua vez, deram origem a novas baterias como:
- Níquel-ferro (Ni-Fe). Eles consistiam em tubos finos enrolados por folhas de aço niquelado. Nas placas positivas havia hidróxido de níquel(III) (Ni(OH)3) e nas negativas ferro (Fe). O eletrólito utilizado é o hidróxido de potássio (KOH). Embora sua duração fosse muito longa, eles foram descontinuados devido ao seu baixo desempenho e alto custo.
- Níquel-cádmio (Ni-Cd). Eles são compostos por um ânodo de cádmio (Cd) e um cátodo de hidróxido de níquel (III) (Ni(OH)).3) e hidróxido de potássio (KOH) como eletrólito. Esses acumuladores são perfeitamente recarregáveis, mas possuem baixa densidade de energia (apenas 50Wh/kg). Além disso, são cada vez menos utilizados devido ao seu alto efeito de memória (redução da capacidade da bateria quando realizamos cargas incompletas) e porque o cádmio é altamente poluente.
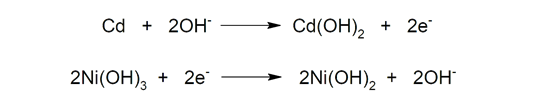
- Níquel-hidreto (Ni-MH). Eles usam oxihidróxido de níquel (NiOOH) como ânodo e uma liga de hidreto de metal como cátodo. Possuem maior capacidade de carga e menor efeito memória em comparação com as baterias Ni-Cd, além de não afetarem o meio ambiente já que não possuem Cd (muito poluente e perigoso). Eles foram os pioneiros em serem usados para veículos elétricos, pois são perfeitamente recarregáveis.
- Baterias de íon de lítio (Li-ION). Eles usam um sal de lítio como eletrólito. São as baterias mais utilizadas em pequenos eletrônicos, como celulares e outros aparelhos portáteis. Destacam-se pela enorme densidade energética, somada ao fato de serem muito leves, de tamanho pequeno e bom desempenho, mas com vida útil máxima de três anos. Outra vantagem que eles têm é seu baixo efeito de memória. Além disso, quando superaquecidos podem explodir, já que seus elementos são inflamáveis, por isso seu custo de produção é alto porque elementos de segurança devem ser incorporados.
- Baterías de polímero de litio (LiPo). São uma variação das baterias de lítio comuns, têm melhor densidade de energia e melhor taxa de descarga, mas têm a desvantagem de serem inúteis se perderem a carga abaixo de 30%, por isso é essencial não deixá-las descarregar totalmente. Elas também podem superaquecer e explodir, por isso é muito importante nunca demorar muito para olhar a bateria, ou guardá-la sempre em um local seguro e longe de substâncias inflamáveis.
celular e bateria

Os termos alinhar y bateria neste contexto são sinônimos, e vêm desde os primeiros dias da manipulação humana da eletricidade. Os primeiros acumuladores consistiam em grupos de células ou discos metálicos para aumentar a corrente inicialmente fornecida, e que podiam ser dispostos de duas formas: uma sobre a outra, formando um alinharou um ao lado do outro, na forma de bateria.
Deve-se esclarecer, no entanto, que em muitos países de língua espanhola apenas o termo bateriae é o preferido acumulador para outros dispositivos elétricos, como capacitores, etc.
