Explicamos o que são os metais, como são classificados e quais são suas propriedades físicas. Exemplos de metais e o que são não metais.

O que são metais?
No campo da química, os metais ou metálicos são conhecidos como aqueles elementos da Tabela Periódica que Eles são caracterizados por serem bons condutores de eletricidade e calor.. Esses elementos têm altas densidades e geralmente são sólidos à temperatura ambiente (exceto mercúrio). Muitos, além disso, podem refletir a luz, o que lhes confere o brilho característico.
os metais são os elementos mais numerosos da tabela periódica e alguns fazem parte dos mais abundantes na crosta terrestre. Uma parte deles costuma ser encontrada em estado de maior ou menor pureza na natureza, embora a maioria faça parte de minerais do subsolo terrestre e devam ser separados pelo homem para utilizá-los.
os metais têm ligações características chamadas “ligações metálicas”. En este tipo de enlace los átomos metálicos se encuentran unidos entre sí de forma que sus núcleos atómicos se juntan con los electrones de valencia (electrones ubicados en la última capa electrónica, es decir, electrones más externos), que forman una especie de “nube ” ao seu redor. Assim, na ligação metálica, os átomos metálicos estão localizados muito próximos uns dos outros, e todos ficam “imersos” em seus elétrons de valência, formando a estrutura metálica.
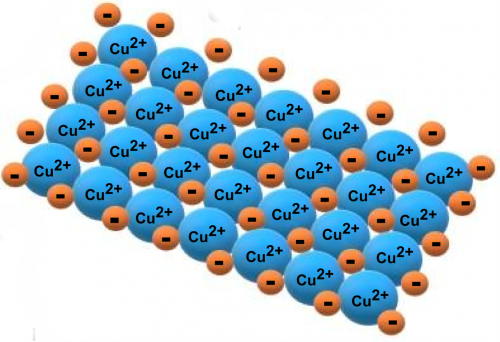
Por outro lado, os metais pode formar ligações iônicas com ametais (por exemplo, cloro e flúor), o que leva à formação de sais. Esse tipo de ligação é formado pela atração eletrostática entre íons de sinais diferentes, onde os metais formam íons positivos (cátions) e os não metais, íons negativos (ânions). Quando esses sais se dissolvem na água, eles se dissociam em seus íons.
Mesmo as ligas de um metal com outro (ou com um ametal) continuam sendo materiais metálicos, como é o caso do aço e do bronze, embora sejam misturas homogêneas.
os metais ter servido o humanidade desde tempos imemoriais graças ao seu caráter ideal para formar ferramentas, estátuas ou estruturas de todos os tipos, devido às suas propriedades físicas particulares:
- Maleabilidade. Sob compressão, alguns metais podem formar folhas finas de material homogêneo.
- Ductilidade. Quando submetidos a forças de tração, alguns metais podem formar fios ou fios de material homogêneo.
- Tenacidade. Capacidade de resistir à fratura, quando submetido a forças bruscas (golpes, quedas, etc.).
- Força mecânica. Capacidade de suportar tração, compressão, torção e outras forças sem ceder em sua estrutura física ou deformar.
Além do mais, seu brilho os torna ideais para forjar joias e elementos decorativos e sua boa condução de eletricidade os torna indispensáveis na transmissão de corrente elétrica nos modernos sistemas de energia elétrica.
Veja também: Condutividade elétrica
tipos de metais

Os elementos metálicos podem ser de vários tipos, de acordo com os quais são agrupados na Tabela Periódica. Cada grupo tem propriedades compartilhadas:
- Metais alcalinos. São brilhantes, macios e muito reativos em condições normais de pressão e temperatura (1 atm e 25º C), por isso nunca são puros na natureza. Eles têm densidades baixas e são bons condutores de calor e eletricidade. Eles também têm pontos de fusão e ebulição baixos. Na Tabela Periódica ocupam o grupo I (1). Neste grupo também está o hidrogênio (que não é um metal).
- Metais alcalinos terrestres. Eles estão localizados no grupo II (2) da Tabela Periódica. Seu nome vem das propriedades alcalinas de seus óxidos (anteriormente chamados de “terras”). Eles tendem a ser mais duros e menos reativos que os alcalinos. Eles são brilhantes e bons condutores de calor e eletricidade. Eles têm baixa densidade e cor.
- metais de transição. A maioria dos metais pertence a essa categoria. Ocupam a região central da Tabela Periódica e quase todos são duros, com altos pontos de fusão e ebulição, e boa condução de calor e eletricidade.
- Lantánidos. Também chamados de lantanóides, são as chamadas “terras raras” da Tabela Periódica, que com os actinídeos formam os “elementos de transição interna”. São elementos muito semelhantes entre si e, apesar do nome, são muito abundantes na superfície terrestre. Eles têm um comportamento magnético (quando interagem com um campo magnético, por exemplo, o campo magnético gerado por um ímã) e espectral (quando a radiação incide sobre eles) muito característico.
- Actinídeos. Juntamente com as terras raras, eles formam os “elementos de transição interna” e são muito semelhantes entre si. Eles têm números atômicos elevados e muitos deles são radioativos em todos os seus isótopos, o que os torna extremamente raros na natureza.
- Transactinídeos. Também chamados de “elementos superpesados”, são aqueles que excedem em número atômico o mais pesado dos actinídeos, o laurêncio (103). Todos os isótopos desses elementos têm uma meia-vida muito curta, são todos radioativos e foram obtidos por síntese em laboratório, por isso têm os nomes dos físicos responsáveis por sua criação.
exemplos de metais

- Alcalinos. Lítio (Li), sódio (Na), potássio (K), rubídio (Rb), césio (Cs), frâncio (Fr).
- Alcalinotérreos. Berílio (Be), magnésio (Mg), cálcio (Ca), estrôncio (Sr), bário (Ba) e rádio (Ra).
- metais de transição. Escândio (Sc), titânio (Ti), vanádio (V), cromo (Cr), manganês (Mn), ferro (Fe), cobalto (Co), níquel (Ni), cobre (Cu), zinco (Zn), ítrio (Y), zircônio (Zr), nióbio (Nb), molibdênio (Mo), tecnécio (Tc), rutênio (Ru), ródio (Rh), paládio (Pd), prata (Ag), cádmio (Cd), lutécio (Lu), háfnio (Hf), tântalo (Ta), tungstênio (W), rênio (Re), ósmio (Os), irídio (Ir), platina (Pd), ouro (Au), mercúrio (Hg), Lawrence (Lr), Rutherfordius (Rf), Dubnius (Db), Seaborgius (Sg), Bohrius (Bh), Hasius (Hs), Meitnerius (Mt), Darmstadius (Ds), Roentgenian (Rg), Copérnico (Cn).
- Terras raras Lantânio (La), cério (Ce), praseodímio (Pr), neodímio (Nd), promécio (Pm), samário (Sm), európio (Eu), gadolínio (Gd), térbio (Tb), disprósio (Dy), hólmio (Ho), érbio (Er), túlio (Tm), itérbio (Yb), lutécio (Lu).
- Actinídeos. Actínio (Ac), Tório (Th), Protactínio (Pa), Urânio (U), Neptúnio (Np), Plutônio (Pu), Amerício (Am), Cúrio (Cm), Berquélio (Bk), Califórnio (Cf), einstênio (Es), férmio (Fm), mendeleviano (Md), nobre (No), lawrentius (Lr).
- Transactinídeos. Rutherfordius (Rf), dubnius (Db), seaborgius (Sg), bohrium (Bh), hassio (Hs), meitnerium (Mt), darmstadium (Ds), roentgenian (Rg), copernicus (Cn), nihonium (Nh), fleroviano (Fl), moscoviano (Mc), livermoriano (Lv), tenaz (Ts).
Quais são os não-metais?

Os ametais são elementos com propriedades muito diferentes das dos metais, embora também existam compostos chamados metaloides, que possuem propriedades e características intermediárias entre metais e não metais. não-metais eles formam ligações covalentes quando formam moléculas entre si. Esses compostos, ao contrário dos metais, não são bons condutores de corrente elétrica e calor, nem são brilhantes.
Oxigênio, carbono, hidrogênio, nitrogênio, fósforo e enxofre, que são os elementos fundamentais para a vida, fazem parte dos não-metais. Esses elementos não metálicos podem ser sólidos, líquidos ou gasosos.
Eles são classificados principalmente como:
- Halogênios. Flúor (F), cloro (Cl), bromo (Br), iodo (I), astato (At) e teneso (Ts).
- Gases nobres. Helio (He), neón (Ne), argón (Ar), kriptón (Kr), xenón (Xe), radón (Rn), oganesón (Og).
- Outros não metais. Hidrogênio (H), carbono (C), enxofre (S), selênio (Se), nitrogênio (N), oxigênio (O) e fósforo (P).
Mais em: Não-metais
Referências
- “Metal” na Wikipedia, a enciclopédia livre.
- “Metais” na área de tecnologia.
- 20 exemplos de metais e não metais.
