Explicamos o que é uma reação exotérmica e suas diferenças com uma reação endotérmica. Além disso, exemplos dessa reação química.

O que é uma reação exotérmica?
Uma reação exotérmica é aquela que quando ocorre libera energia na forma de calor ou luz para o ambiente. Quando ocorre esse tipo de reação, os produtos obtidos possuem energia menor que os reagentes iniciais.
A entalpia é uma magnitude que define o fluxo de energia térmica em processos químicos que ocorrem a pressão constante. Além disso, essa magnitude representa a troca de energia entre um sistema termodinâmico e seus arredores. A variação dessa magnitude (ΔH) em uma reação química é usada para classificá-la como endotérmica ou exotérmica.
ΔH>0 reação endotérmica.
ΔH<0 reação exotérmica.
As reações exotérmicas são muito importantes nas ciências bioquímicas. Por meio de reações desse tipo, os organismos vivos obtêm a energia necessária para sustentar a vida em um processo chamado metabolismo.
A maioria das reações exotérmicas são oxidação, e quando são muito violentos podem gerar fogo, como na combustão. Outros exemplos dessas reações são as transições da matéria de um estado de agregação para outro de menor energia, como de gás para líquido (condensação), ou de líquido para sólido (solidificação).
De fato, muitas reações exotérmicas são perigosas para a saúde porque a energia liberada é abrupta e descontrolada, podendo causar queimaduras ou outros danos aos seres vivos.
Veja também: Princípio da conservação da energia
Diferenças entre reações exotérmicas e endotérmicas

Em qualquer reação química, a energia é conservada. Isto constitui a lei da conservação da energia: a energia não se cria nem se destrói, apenas se transforma.
Nas reações endotérmicas, a energia é absorvida para transformar reagentes em produtos.. Nesse tipo de reação, as ligações das moléculas que constituem os reagentes são quebradas para formar novos componentes. Este processo de quebra de ligação precisa da energia em questão. Um exemplo disso é o processo de eletrólise da água, onde é fornecida energia elétrica à molécula de água para quebrá-la e transformá-la nos elementos que a constituem.
Por outro lado, nas reações exotérmicas, os reagentes liberam energia química contida nas ligações que suas moléculas formam. A energia liberada pode ser na forma de calor ou luz.
Mais em: Reações endotérmicas
Exemplos de reação exotérmica
Algumas reações exotérmicas conhecidas são:
- A combustão. É uma reação de oxidação muito rápida que ocorre entre materiais chamados combustíveis e oxigênio. Os combustíveis são compostos principalmente de carbono, hidrogênio e, em alguns casos, enxofre. Exemplos de combustíveis são gás metano, gasolina e gás natural. Essa reação libera grandes quantidades de calor, o que pode levar a um incêndio.
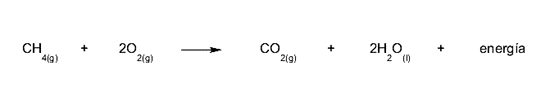
- A oxidação da glicose. Essa é a reação que os animais realizam para obter energia metabólica: retiramos o oxigênio da respiração e o utilizamos para oxidar os açúcares, quebrando a molécula de glicose em moléculas mais simples (glicolise) e obtendo como recompensa moléculas de ATP, ricas em energia química.
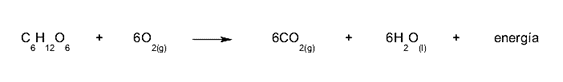
- A mistura de potássio e água. O potássio é um dessecante poderoso que quando misturado com água libera hidrogênio e enormes quantidades de energia em uma explosão. Isso ocorre com todos os metais alcalinos, embora nem sempre com a mesma quantidade de energia liberada.
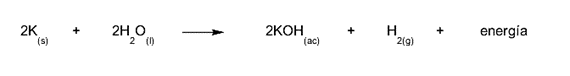
- A formação de amônia. Para formar amônia (NH3) nitrogênio (N2) e hidrogênio (H2), o que significa obter uma molécula menos energética do que as moléculas colocadas em reação. Essa diferença de energia deve ser liberada e ocorre como um aumento de temperatura (calor).
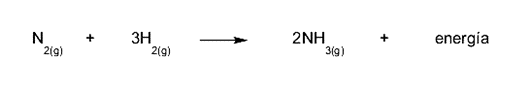
Referências
- “Reação endotérmica e exotérmica” no Portal Acadêmico CCH da Universidade Nacional Autônoma do México (UNAM)
- “Reação exotérmica” em EcuRed, Conhecimento com todos e para todos.
- “Obtenção de amônia” em LaGuía.
