Explicamos o que é uma solução química e suas principais características. Além disso, como é classificado e o que é concentração.

O que é uma solução química?
É chamado de solução ou solução química um uma mistura homogênea de dois ou mais produtos químicos puros. Uma solução pode ocorrer no nível molecular ou iônico e não é uma reação química.
Desta forma, a solução resultante da mistura de dois componentes terá uma única fase reconhecível (sólido, líquido ou gasoso), embora seus componentes separados tenham fases diferentes. Por exemplo, ao dissolver açúcar em água.
Toda solução química possui pelo menos dois componentes: um soluto (que se dissolve no outro) e um solvente ou solvente (que dissolve o soluto). No caso do açúcar dissolvido em água, o açúcar é o soluto e a água é o solvente.
A formação de soluções e misturas de substâncias é essencial para o desenvolvimento de novos materiais e para a compreensão das forças químicas que permitem a combinação da matéria. Isso é de particular interesse para as áreas de química, biologia e geoquímica, entre outras.
Veja também: Entalpia
Características de uma solução química

Em geral, qualquer solução química é caracterizada por:
- Soluto e solvente não podem ser separados por métodos físicos como filtração ou peneiramento, pois suas partículas constituem novas interações químicas.
- Eles possuem um soluto e um solvente (pelo menos) em alguma proporção detectável.
- À primeira vista, seus elementos constitutivos não podem ser distinguidos.
- O soluto e o solvente só podem ser separados por métodos como destilação, cristalização ou cromatografia.
Tipos de solução química
As soluções químicas podem ser classificadas de acordo com dois critérios.
A proporção de soluto para solvente:
- Diluído. Quando a quantidade de soluto em relação ao solvente é muito pequena. Por exemplo: 1 grama de açúcar em 100 gramas de água.
- Concentradas. Quando a quantidade de soluto em relação ao solvente é grande. Por exemplo: 25 gramas de açúcar em 100 gramas de água.
- Saturadas. Quando o solvente não aceita mais soluto a uma certa temperatura. Por exemplo: 36 gramas de açúcar em 100 gramas de água a 20 °C.
- Supersaturado. Como a saturação tem a ver com a temperatura, se aumentarmos a temperatura, o solvente pode ser forçado a absorver mais soluto do que normalmente consegue, obtendo uma solução supersaturada (digamos supersaturada). Assim, submetida ao aquecimento, a solução absorverá muito mais soluto do que normalmente poderia.
O estado de agregação dos componentes:
Sólidas:
- Sólido em sólido. Tanto o soluto quanto o solvente estão no estado sólido. Por exemplo: ligas como latão (cobre e zinco).
- Gás em sólido. O soluto é um gás e o solvente é um sólido. Por exemplo: hidrogênio em paládio, poeira vulcânica, entre outros.
- Líquido em sólido. O soluto é um líquido e o solvente é um sólido. Por exemplo: amálgamas (mercúrio e prata)
Líquidas:
- Sólido em líquido. Pequenas quantidades de sólido (soluto) são geralmente dissolvidas em um líquido (solvente). Por exemplo: açúcar dissolvido em água.
- Gás em líquido. Um gás (soluto) se dissolve em um líquido (solvente). Por exemplo: oxigênio dissolvido na água do mar que é responsável pela vida aquática no planeta.
- Líquido em líquido. Tanto o soluto quanto o solvente são líquidos. Por exemplo: amálgamas (mercúrio e prata)
Refrigerantes:
- gás no gás Tanto o soluto quanto o solvente são gases. Em muitas ocasiões, essas soluções são consideradas misturas devido às interações fracas entre as partículas de gás. Por exemplo: oxigênio no ar.
- Gás em sólido. O soluto é um gás e o solvente é um sólido. Por exemplo: poeira dissolvida no ar.
- líquido em gás O soluto é um líquido e o solvente é um gás. Por exemplo: vapor de água no ar.
Concentração de uma solução química
A concentração é uma magnitude que descreve a proporção de soluto para solvente em uma solução. Esta magnitude é expressa em dois tipos diferentes de unidades:
Unidades físicas. Aqueles que são expressos em relação ao peso e volume da solução, em forma de porcentagem (multiplicar por 100). Por exemplo:
- % Peso/peso. É expressa em gramas de soluto por grama de solução.
- %volume/volume. É expresso em centímetros cúbicos (cc) de soluto por cc de solução.
- % Peso/volume. Combine os dois anteriores: gramas de soluto por cc de solução.
Unidades químicas. Aqueles que são expressos em sistemas de unidades químicas. Por exemplo:
- Molaridade (M). É expresso em número de moles de soluto por litro de solução ou quilograma de solução. É calculado da seguinte forma:
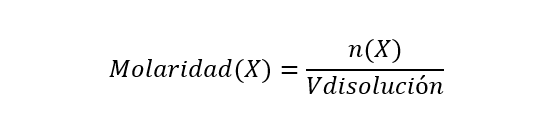
Onde n(X) é o número de moles do componente X e Vdisolución é o volume da solução. A molaridade é expressa em moles/Lsolução.
- Fração molar (Xi). É expresso em moles de um componente (solvente ou soluto) em relação ao total de moles da solução, como segue:
Xsolução = moles de soluto / (moles de soluto + moles de solvente)
Xsolvente = moles de solvente / (moles de soluto + moles de solvente)
Sempre contemplando que:
Xsolvente + Xsolução = 1
A fração molar é adimensional, ou seja, não é expressa em unidades de medida.
- Molalidade (m). É a razão entre o número de moles de qualquer soluto dissolvido por quilograma de solvente. É calculado da seguinte forma:
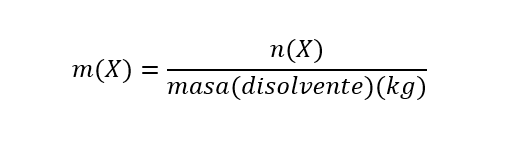
Onde m(X) é a molalidade de X, n(X) é o número de moles de X e massa (solvente) é a massa de solvente expressa em kg. É importante esclarecer que a molaridade é expressa por kg (1000g) de solvente. É expresso em unidades de mol/kg.
Referências
- Química. Marquez, Edward J. Martinez. Cengage Learning Publishers. (2010) ISBN 6074811652 .
- Química Geral. Christen, Hans Rudolph. revertido (1977) ISBN 9788429171310.
