Explicamos quais são os grupos da tabela periódica e as características de cada um. Além disso, os períodos da tabela periódica.
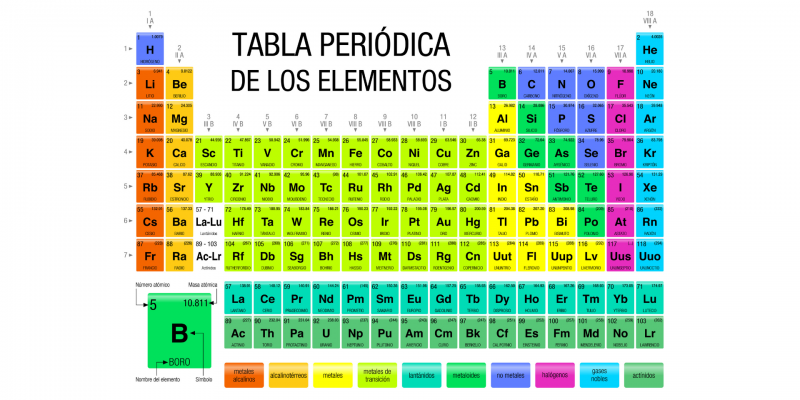
Quais são os grupos da tabela periódica?
Em química, os grupos da Tabela Periódica são as colunas de elementos que o compõemcorrespondendo a famílias de elementos químicos que compartilham muitas de suas características atômicas.
De fato, a função primordial da Tabela Periódica, criada pelo químico russo Dmitri Mendeleev (1834-1907), é justamente servir de diagrama para a classificação e organização das diferentes famílias de elementos químicos conhecidos, de modo que os grupos são um de seus componentes mais importantes.
Esses grupos são representados nas colunas da tabela, enquanto as linhas constituem os períodos. Existem 18 grupos diferentes, numerados de 1 a 18, cada um dos quais agrupa um número variável de elementos químicos. Os elementos de cada grupo têm o mesmo número de elétrons em sua última camada atômica.motivo pelo qual apresentam propriedades químicas semelhantes, pois as propriedades químicas dos elementos químicos estão fortemente relacionadas aos elétrons localizados na última camada atômica.
A numeração dos diferentes grupos dentro da tabela é atualmente estabelecida pela União Internacional de Química Pura e Aplicada (IUPAC) e corresponde a algarismos arábicos (1, 2, 3.. 18), em substituição ao método tradicional europeu que utilizava Algarismos romanos e letras (IA, IIA, IIIA.. VIIIA) e o método americano que também usava algarismos romanos e letras, mas em um arranjo diferente do método europeu.
- IUPAC. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18.
- sistema europeu. IA, IIA, IIIA, IVA, VA, VIA, VIIA, VIIIA, VIIIA, VIIIA, IB, IIB, IIIB, IVB, VB, VIB, VIIB, VIIIB.
- sistema americano. IA, IIA, IIIB, IVB, VB, VIB, VIIB, VIIIB, VIIIB, VIIIB, IB, IIB, IIIA, IVA, VA, VIA, VIIA, VIIIA.
Deste modo, cada elemento presente na tabela periódica corresponde sempre a um grupo e período específicoque refletem a forma de classificar a matéria que a humanidade desenvolveu cientificamente.
Veja também: número atômico
Quais são os grupos da tabela periódica?
A seguir, descreveremos cada um dos grupos da Tabela Periódica usando a numeração IUPAC e o antigo sistema europeu:
- Grupo 1 (anteriormente IA) ou metais alcalinos. Composto pelos elementos lítio (Li), sódio (Na), potássio (K), rubídio (Rb), césio (Ce) e frâncio (Fr), todos comuns nas cinzas vegetais e de natureza básica quando fazem parte de óxidos . Possuem baixa densidade, cor própria e costumam ser macios. Nesse grupo, o hidrogênio (H) também costuma ser incluído, embora também seja comum a presença de uma posição autônoma entre os elementos químicos. Os metais alcalinos são extremamente reativos e precisam ser armazenados em óleo para evitar que reajam com a umidade do ar. Além disso, nunca são encontrados como elementos livres, ou seja, sempre fazem parte de algum composto químico.
- Grupo 2 (anteriormente IIA) ou metais alcalino-terrosos. Composto pelos elementos berílio (Be), magnésio (Mg), cálcio (Ca), estrôncio (Sr), bário (Ba) e rádio (Ra). O nome “alcalino-terroso” vem do nome que seus óxidos receberam no passado (terra). São metais macios (embora mais duros que os do grupo 1), de baixa densidade, bons condutores e com eletronegatividade menor ou igual a 1,57 segundo a escala de Pauling (escala estabelecida para organizar os valores de eletronegatividade dos átomos, onde o flúor (F) é o mais eletronegativo e frâncio (Fr) é o menos eletronegativo). São elementos menos reativos que os do grupo 1, mas mesmo assim são muito reativos. O último da lista (Ra) é radioativo e tem uma meia-vida muito curta (tempo que um átomo radioativo leva para decair), por isso muitas vezes não é incluído nas listas.
- Grupo 3 (anteriormente IIIA) ou família do escândio. Composto pelos elementos escândio (Sc), ítrio (Y), lantânio (La) e actínio (Ac), ou por lutécio (Lu) e laurêncio (Lr) (há um debate entre os especialistas sobre qual desses elementos deve ser incluído na este agrupamento). São elementos sólidos e brilhantes, muito reativos e com grande tendência à oxidação, bons condutores de eletricidade.
- Grupo 4 (anteriormente VAT) ou família de titânio. Composto pelos elementos titânio (Ti), zircônio (Zr), háfnio (Hf) e ruterfórdio (Rf), que são metais altamente reativos que, quando expostos ao ar, ficam vermelhos e podem inflamar-se espontaneamente (ou seja, são pirofóricos). O último (Rf) da família é um elemento sintético e radioativo.
- Grupo 5 (anteriormente VA) ou família do vanádio. Composto pelos elementos vanádio (V), nióbio (Nb), tântalo (Ta) e dúbnio (Db), metais que possuem 5 elétrons em suas camadas atômicas mais externas. O vanádio é bastante reativo, pois tem valência variável, mas os outros são muito pouco, e o último (Db) é um elemento sintético que não existe na natureza.
- Grupo 6 (anteriormente VIA) ou família do cromo. Composto pelos elementos cromo (Cr), molibdênio (Mo), tungstênio (W) e seaborgium (Sg), todos metais de transição, e Cr, Mo e W são refratários. Eles não apresentam características eletrônicas uniformes, apesar de seu comportamento químico semelhante.
- Grupo 7 (anteriormente VIIA) ou família do manganês. Composto pelos elementos manganês (Mn), tecnécio (Tc), rênio (Re) e bório (Bh), sendo o primeiro (Mn) muito comum e os demais extremamente raros, principalmente o tecnécio (que não possui isótopos). ) e rênio (que existe apenas em traços na natureza).
- Grupo 8 (anteriormente VIIIA) ou família do ferro. Composto pelos elementos ferro (Fe), rutênio (Ru), ósmio (Os) e hássio (Hs), metais de transição que possuem oito elétrons em suas camadas externas. O último da lista (Hs) é um elemento sintético que existe apenas em laboratório.
- Grupo 9 (anteriormente VIIIA) ou família do cobalto. Compostos pelos elementos cobalto (Co), ródio (Rh), irídio (Ir) e meitnério (Mr), são metais de transição sólidos à temperatura ambiente, sendo que o último (Mr) é sintético e existe apenas em laboratórios.
- Grupo 10 (anteriormente VIIIA) ou família do níquel. Compostos pelos elementos níquel (Ni), paládio (Pd), platina (Pt) e darmstadtium (Ds), são metais de transição sólidos à temperatura ambiente, que abundam na natureza em sua forma elementar, exceto o níquel, que possui um enorme reactividade, pelo que existe formando compostos químicos, e ademais abunda nos meteoritos. Possuem propriedades catalíticas que os tornam muito importantes na indústria química e na engenharia aeroespacial.
- Grupo 11 (anteriormente IB) ou família do cobre. Composto pelos elementos cobre (Cu), prata (Ag), ouro (Au) e roentgenium (Rg), chamados de “metais de cunhagem” por serem utilizados como insumo para moedas e joias. O ouro e a prata são metais preciosos, o cobre, por outro lado, é muito útil industrialmente. A única exceção é o roentgenium, que é sintético e não existe na natureza. Eles são bons condutores elétricos e a prata tem níveis muito altos de condução de calor e refletância de luz. São metais muito macios e dúcteis, amplamente utilizados pela humanidade.
- Grupo 12 (anteriormente IIB) ou família do zinco. Composto pelos elementos zinco (Zn), cádmio (Cd) e mercúrio (Hg), embora diferentes experimentos com o elemento sintético copernicium (Cn) pudessem incluí-lo no grupo. Os três primeiros (Zn, Cd, Hg) estão presentes em abundância na natureza, e os dois primeiros (Zn, Cd) são metais sólidos, sendo o mercúrio o único metal líquido à temperatura ambiente. O zinco é um elemento importante para o metabolismo dos seres vivos, enquanto os demais são altamente tóxicos.
- Grupo 13 (anteriormente IIIB) ou família do boro. Compostos pelos elementos boro (B), alumínio (Al), gálio (Ga), índio (In), tálio (Tl) e nihônio (Nh), também são chamados de “terrosos”, pois são muito abundantes no crosta , exceto o último da lista, sintético e inexistente na natureza. A popularidade industrial do alumínio fez com que o grupo também fosse conhecido como o “grupo do alumínio”. Esses elementos possuem três elétrons em sua camada externa, são metais com ponto de fusão muito baixo, exceto o boro, que tem ponto de fusão muito alto e é um metalóide.
- Grupo 14 (antes IVB) o carbonoideos. Compostos pelos elementos carbono (C), silício (Si), germânio (Ge), estanho (Sn), chumbo (Pb) e fleróvio (Fl), são elementos amplamente conhecidos e abundantes, principalmente o carbono, central para a química dos seres vivos. Este elemento não é metálico, mas à medida que se desce no grupo os elementos tornam-se cada vez mais metálicos, até chegar ao chumbo. São também elementos amplamente utilizados na indústria e muito abundantes na crosta terrestre (o silício constitui 28% dela), exceto o fleróvio, sintético e radioativo com meia-vida muito curta.
- Grupo 15 (antes VB) o nitrogenoideos. Compostos pelos elementos nitrogênio (N), fósforo (P), arsênico (As), antimônio (Sb), bismuto (Bi) e o elemento sintético Muscovium (Mc), também são conhecidos como pnicogênios, são muito abundantes e muito reativo quando em altas temperaturas. Eles têm cinco elétrons em sua camada externa e, como o grupo anterior, assumem propriedades metálicas à medida que avançamos no grupo.
- Grupo 16 (antes VIB) o calcógenos o anfígenos. Compostos pelos elementos oxigênio (O), enxofre (S), selênio (Se), telúrio (Te), polônio (Po) e fígado (Lv), são, com exceção do último (Lv, sintético), elementos muito comuns usados industrialmente. , os dois primeiros (O, S) também envolvidos em processos bioquímicos típicos. Eles têm seis elétrons em sua camada atômica externa e alguns deles tendem a formar compostos ácidos ou básicos, daí o nome de anfigênios (do grego anfiteatro“em ambos os lados”, e joelhos, “produzir”). Entre o grupo, destaca-se o oxigênio, com tamanho muito pequeno e enorme reatividade.
- Grupo 17 (anteriormente VIIB) ou halogênio. Compostos pelos elementos flúor (F), cloro (Cl), bromo (Br), iodo (I), astato (At) e teneso (Ts), geralmente são encontrados em seu estado natural como moléculas diatômicas que tendem a formar moléculas mononegativas íons chamados haletos. O último da lista (os Ts), porém, é sintético e não existe na natureza. São elementos abundantes na bioquímica, com enorme poder oxidante (principalmente o flúor). Seu nome vem das palavras gregas mortal (“sal e joelhos (“produtor”), ou seja, “produtores de sais”.
- Grupo 18 (anteriormente VIIIB) ou gases nobres. Composto pelos elementos hélio (He), néon (Ne), argônio (Ar), criptônio (Kr), xenônio (Xe), radônio (Rn) e oganeson (Og), seu nome vem do fato de que na natureza tendem estar na forma gasosa e ter uma reatividade muito baixa, o que os torna excelentes isolantes para diferentes indústrias. Eles têm pontos de ebulição e fusão muito próximos, de modo que podem ser líquidos apenas em uma pequena faixa de temperaturas e, com exceção do radônio (muito radioativo) e do oganeson (sintético), eles são abundantes no ar da Terra e no universo. (especialmente o hélio, produzido no coração das estrelas pela fusão do hidrogênio).
Períodos da tabela periódica
Assim como existem grupos, representados em forma de colunas, também existem períodos que são linhas horizontais da tabela periódica. Os períodos estão diretamente relacionados com os níveis de energia de cada elemento, ou seja, com o número de órbitas eletrônicas que envolvem o núcleo.
Por exemplo, ferro (Fe) está no quarto período, ou seja, a quarta linha da tabela, pois possui quatro camadas eletrônicas; enquanto o bário (Ba), com seis camadas, está no sexto período, ou seja, na sexta linha da tabela periódica.
Continuar com: Fórmula Química
Referências
- “Tabela Periódica dos Elementos” na Wikipedia.
- “Grupo Tabela Periódica” em Encyclopedia.us.
- “Grupos da Tabela Periódica” (vídeo) na Khan Academy.
- “Grupos e períodos” em Recursos TIC do Ministério da Educação da Espanha.
- “Grupo (Tabela Periódica)” na Enciclopédia Britânica.
