Explicamos o que é o ponto de ebulição e como é calculado. Exemplos de ponto de ebulição. Ponto de fusão e ponto de congelamento.

Qual é o ponto de ebulição?
o ponto de ebulição é a temperatura na qual a pressão de vapor do líquido (pressão exercida pela fase gasosa sobre a fase líquida em um sistema fechado a uma dada temperatura) se iguala à pressão ao redor do líquido. Quando isso acontece, o líquido se transforma em gás.
O ponto de ebulição é uma propriedade que é fortemente dependente da pressão ambiente. Um líquido submetido a uma pressão muito alta terá um ponto de ebulição maior do que se o submetermos a pressões mais baixas, ou seja, levará mais tempo para entrar em vapor quando for submetido a altas pressões. Devido a essas variações de ponto de ebulição, a IUPAC definiu o ponto de ebulição padrão: é a temperatura na qual um líquido se transforma em vapor à pressão de 1 bar.
Uma questão importante é que o ponto de ebulição de uma substância não pode ser aumentado indefinidamente. Quando aumentamos a temperatura de um líquido além de seu ponto de ebulição e continuamos a aumentá-la, atingimos uma temperatura chamada “temperatura crítica”. A temperatura crítica é a temperatura acima da qual o gás não pode ser transformado em líquido pelo aumento da pressão, ou seja, não pode ser liquefeito. Nesta temperatura, não há fase líquida definida ou fase de vapor.
O ponto de ebulição é diferente para cada substância. Essa propriedade depende da massa molecular da substância e do tipo de forças intermoleculares que ela apresenta (ligações de hidrogênio, dipolo permanente, dipolo induzido), que por sua vez depende se a substância é covalente polar ou covalente apolar (apolar).
Quando a temperatura de uma substância está abaixo de seu ponto de ebulição, apenas uma parte de suas moléculas localizadas em sua superfície terá energia suficiente para quebrar a tensão superficial do líquido e escapar para a fase de vapor. Por outro lado, quando o calor é fornecido ao sistema, há um aumento na entropia do sistema (tendência à desordem das partículas do sistema).
Veja também: Propriedades da matéria
Como é calculado o ponto de ebulição?
Através dos a equação de Clausius-Clapeyron as transições de fase de um sistema composto por um único componente podem ser caracterizadas. Esta equação pode ser usada para calcular o ponto de ebulição de substâncias e é aplicada da seguinte forma:
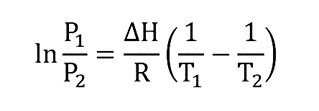
Onde:
P1 é a pressão igual a 1 bar, ou em atmosferas (0,986923 atm)
T1 é a temperatura de ebulição (ponto de ebulição) do componente, medida a uma pressão de 1 bar (P1) e expressa em graus Kelvin (K).
P2 é a pressão de vapor do componente expressa em bar ou em atm.
T2 é a temperatura do componente (expressa em graus Kelvin) na qual a pressão de vapor P é medida2.
𝚫H é a entalpia média de variação de vaporização na faixa de temperatura para a qual o cálculo está sendo feito. É expresso em J/mol ou unidades equivalentes de energia.
R é a constante do gás equivalente a 8.314 J/Kmol
ln é o logaritmo natural
O ponto de ebulição (ponto de ebulição) T é limpo1
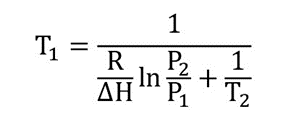
exemplos de ponto de ebulição
Alguns pontos de ebulição registrados e conhecidos sob condições normais de pressão (1 atm) são os seguintes:
- Água: 100ºC
- Hélio: -268,9 ºC
- Hidrogênio: -252,8ºC
- Cálcio: 1484 ºC
- Berílio: 2471 ºC
- Silício: 3265 ºC
- Carbono en forma de grafito: 4827 ºC
- Boro: 3927 ºC
- Molibdênio: 4639 ºC
- Osmio: 5012 ºC
- Wolframio: 5930 ºC
Ponto de fusão

A temperatura na qual um sólido se transforma em um líquido é chamado de ponto de fusão e durante a transição de fase sólido-líquido a temperatura é mantida constante. Nesse caso, é fornecido calor ao sistema até que sua temperatura suba o suficiente para que o movimento de suas partículas na estrutura sólida seja maior, o que faz com que elas se separem e fluam para a fase líquida.
O ponto de fusão também depende da pressão e geralmente é igual ao ponto de congelamento da matéria (no qual um líquido se torna sólido quando resfriado o suficiente) para a maioria das substâncias.
Continuar em: Ponto de Fusão
Ponto de congelamento
O ponto de congelamento é o oposto do ponto de fusão, ou seja, a temperatura na qual um líquido se contrai, suas partículas perdem o movimento e adquirem uma estrutura mais rígida, resistente à deformação e com memória de forma (exclusiva para substâncias no estado sólido). Ou seja, é a temperatura na qual o líquido se transforma em sólido. A fusão requer o fornecimento de energia térmica ao sistema, enquanto o congelamento requer a remoção de energia térmica (resfriamento).
Por outro lado, o ponto de congelamento também depende da pressão. Um exemplo é o que acontece quando a água é resfriada a uma temperatura de 0ºC a 1 atm, quando ela congela e se transforma em gelo. Se ele for resfriado a uma pressão muito diferente de 1 atm, o resultado pode ser muito diferente, por exemplo, se a pressão for muito maior, pode demorar para congelar, pois seu ponto de congelamento é abaixado.
Ponto de fusão e ebulição da água
A água é freqüentemente usada como padrão ao medir os pontos de fusão e ebulição de substâncias. Em termos gerais, À pressão normal, seu ponto de ebulição é de 100ºC e seu ponto de fusão é de 0ºC. (no caso do gelo). Isso pode variar muito nos casos em que a água contém outras substâncias dissolvidas, líquidas ou sólidas, como ocorre com a água do mar, rica em sais, que modifica suas propriedades físicas e químicas.
O impacto da pressão também é muito perceptível. Sabe-se que a 1 atm o ponto de ebulição da água é 100ºCmas levando-o a 0,06 atm ficaríamos surpresos ao notar que ele ferve a 0 ºC (em vez de congelar).
Referências
- Manual pedagógico de práticas de química geral em microescala. Nemer, Beatriz Virgínia Cervantes. Universidade Iberoamericana (2006). ISBN 978-968-859-594-7.
- “Ponto de ebulição” na Wikipedia.
