Explicamos o que são as forças de Van der Waals e em que casos elas se manifestam. Além disso, por que eles têm esse nome e suas características.

O que são forças de Van der Waals?
Um certo tipo de interação é conhecido como forças de Van der Waals ou interações de Van der Waals. forças intermoleculares atrativas ou repulsivasdiferentes daquelas que geram ligações atômicas (iônicas, metálicas ou covalentes do tipo reticulado) ou a atração eletrostática entre íons e outras moléculas.
Antes de mencionar os diferentes tipos de forças de Van der Waals, é importante entender o que é a polaridade química. A polaridade química é uma propriedade das moléculas que tende a separar cargas elétricas em sua estrutura. É uma propriedade intimamente relacionada com as forças intermoleculares (como as de Van der Waals), com a solubilidade e com os pontos de fusão e ebulição. Dependendo da polaridade, as moléculas podem ser classificadas em:
- Moléculas polares. Eles são compostos de átomos com eletronegatividade muito diferentes. O átomo com maior eletronegatividade atrai os elétrons de ligação e fica com uma densidade de carga negativa. Por outro lado, o átomo com a menor eletronegatividade ficará com uma densidade de carga positiva. Essa distribuição de cargas acabará por levar à formação de um dipolo (sistema de duas cargas de sinais opostos e igual magnitude).
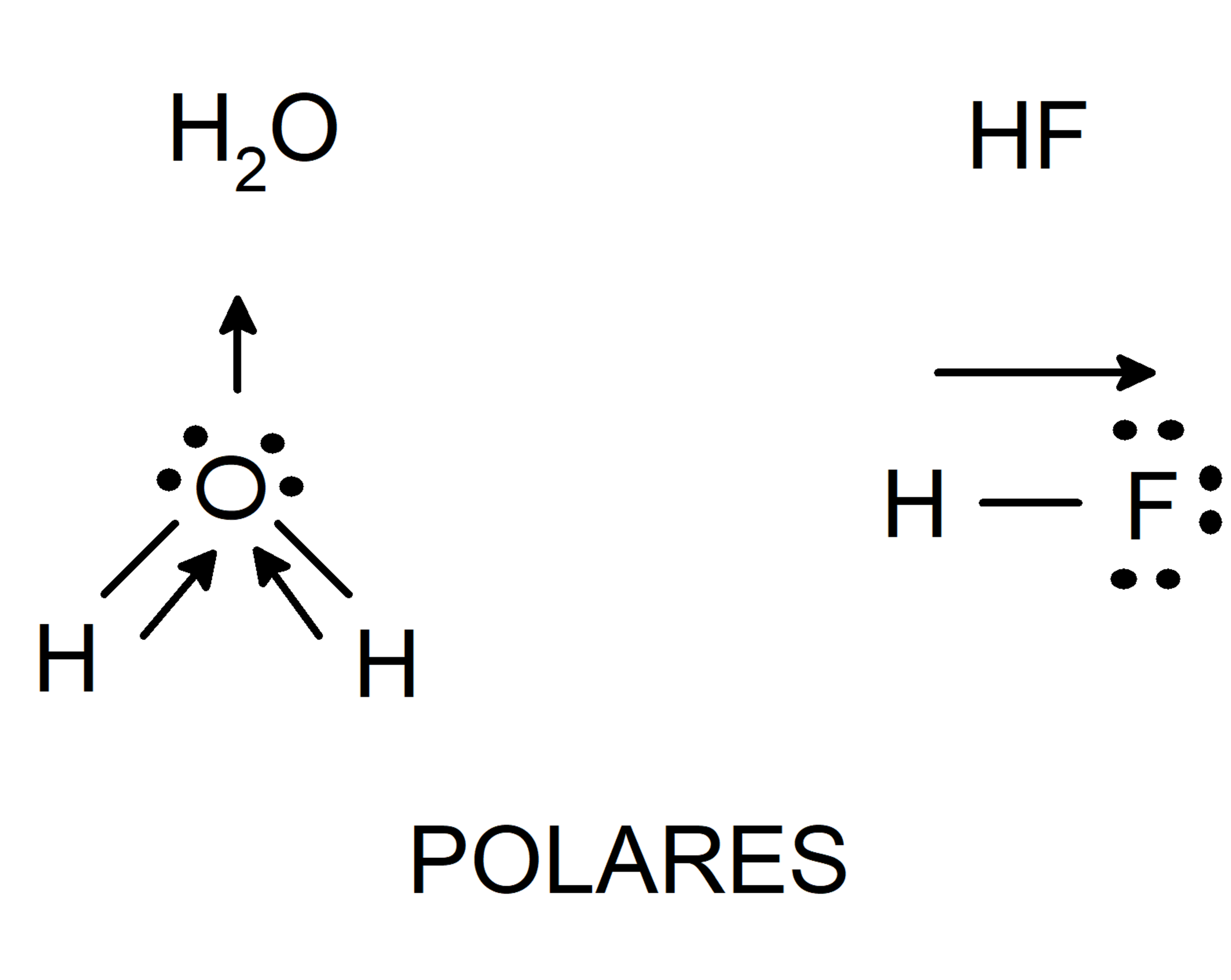
- Moléculas apolares. Eles são formados por átomos com a mesma eletronegatividade, então todos os átomos atraem os elétrons ligantes da mesma maneira.Um fator que também determina a polaridade de uma molécula é a simetria molecular. Existem moléculas compostas por átomos de diferentes eletronegatividades, mas que não são polares. Isso ocorre porque quando as diferentes densidades de carga das partes da molécula são adicionadas, elas se anulam e resultam em um momento dipolar nulo.

Então, as forças de Van der Waals se manifestam de três maneiras particulares:
- Forças atrativas Keesom (interações dipolo-dipolo). São interações entre moléculas polares, ou seja, permanentemente polarizadas. Assim, essas moléculas possuem um polo positivo (com densidade de carga positiva 𝛅+) e um negativo (com densidade de carga negativa 𝛅–), e são orientados de modo que o polo positivo se aproxime do polo negativo.
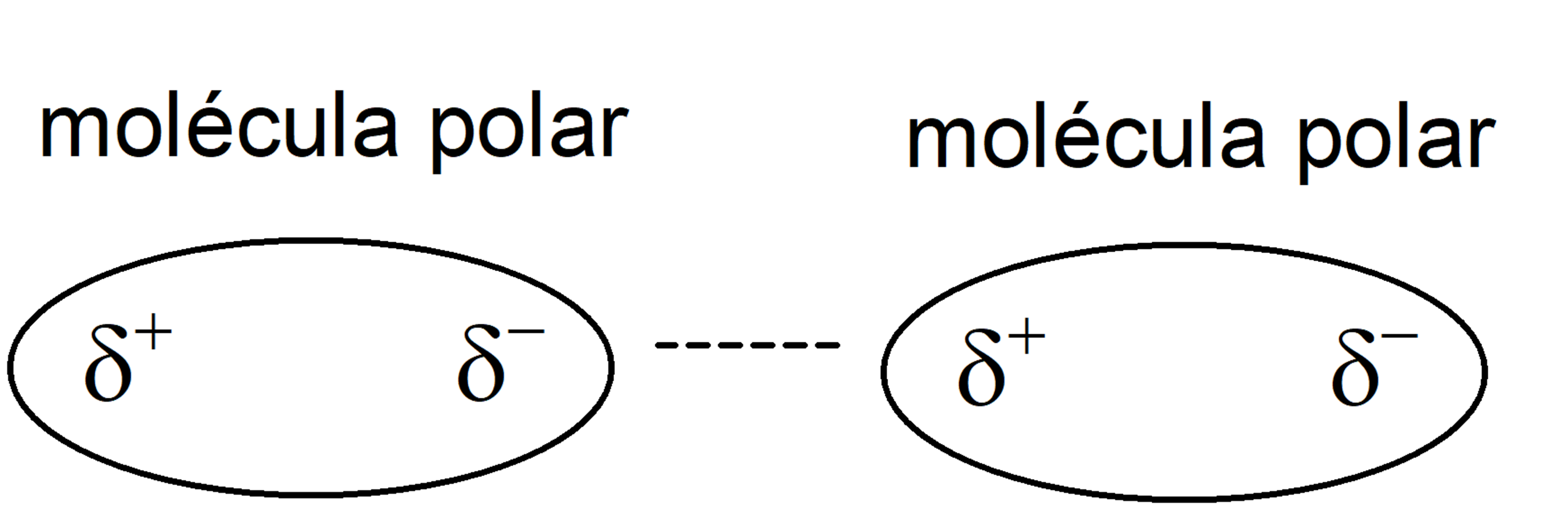
- Forças atrativas de Debye (interações permanentes de dipolo induzidas por dipolo). Ocorrem entre uma molécula polar e outra apolar, mas que apresenta uma polaridade induzida. Nesse tipo de interação, o dipolo induz um dipolo transitório na molécula apolar.

- Forças de dispersão de London (dipolo induzido por dipolo induzido). São interações que ocorrem entre moléculas apolares. O movimento dos elétrons nessas moléculas induz dipolos transientes, o que causa alguma atração entre eles. São interações muito fracas.
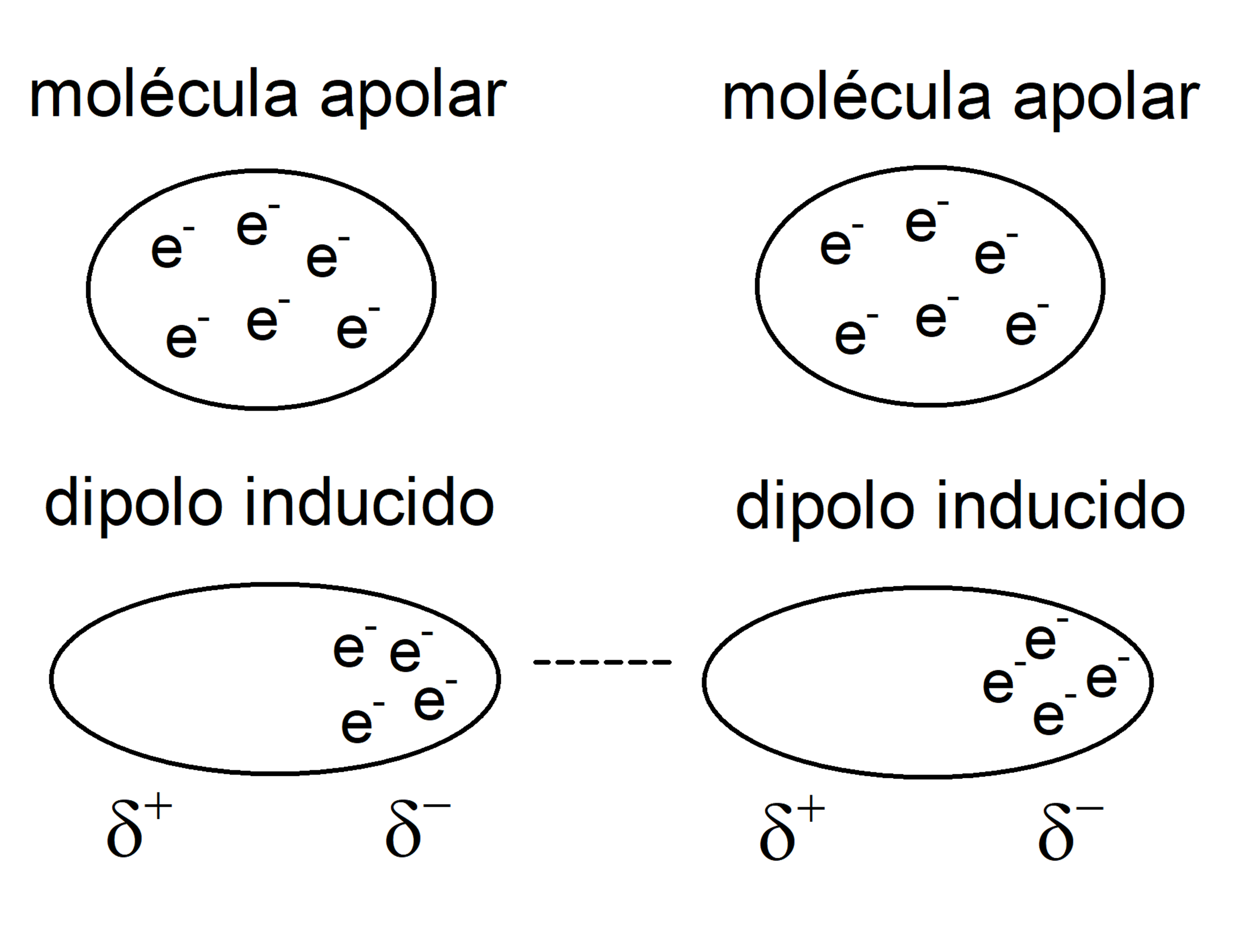
A totalidade dessas forças intermoleculares é conhecida como forças de Van der Waals, nome que presta homenagem ao físico holandês Johannes Diderik van der Waals (1837-1923), o primeiro a propor seus efeitos nas equações de estado de um gás (conhecida como Equação de Van der Waals) em 1873. Por essa descoberta, ele recebeu o Prêmio Nobel de Física em 1910.
Veja também: Energia potencial
Características das Forças de Van der Waals

As forças de Van der Waals são geralmente fraca em comparação com as ligações químicas comuns, o que não impede que sejam essenciais para diversas áreas da física, biologia e engenharia. Graças a eles muitos compostos químicos podem ser definidos.
Forças de Van der Waals crescer com o comprimento da extremidade apolar de uma substânciapois são causadas por correlações entre as polarizações flutuantes entre átomos, moléculas ou superfícies próximas, consequência da dinâmica quântica.
Apresentam anisotropia, ou seja, suas propriedades variam conforme a orientação das moléculas: muitas vezes depende se são atrativas ou repulsivas.
Essas forças são as mais fracas que ocorrem entre as moléculas na natureza: apenas 0,1 a 35 kJ/mol de energia são necessários para vencê-las. Porém, são cruciais para a formação de proteínas.
